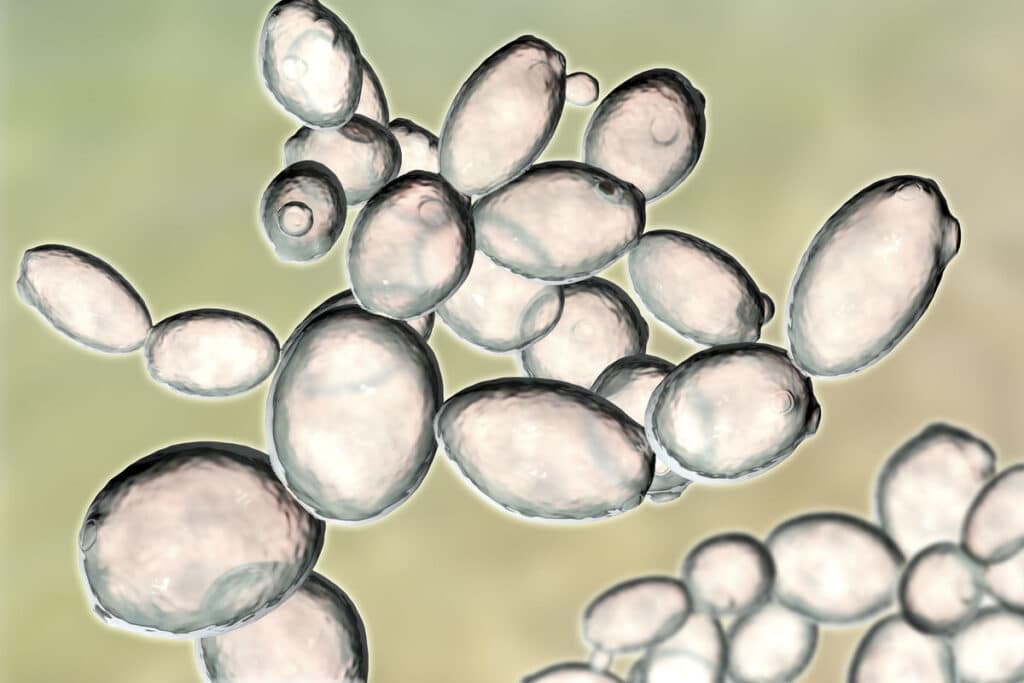
Większości ludzi słowo grzyb kojarzy się przede wszystkim z grzybami kapeluszowymi. Do tej grupy organizmów żywych należą także drożdże, pełniące w przemyśle spożywczym nieporównywalnie większą rolę od borowika czy rydza. Artykuł ten pozwoli zapoznać się czytelnikowi z tą interesującą grupą grzybów, ich metabolizmem, ze szczególnym uwzględnieniem fermentacji alkoholowej i praktycznym wykorzystaniem tego procesu.
Czym są drożdże
Drożdże są jednokomórkowymi organizmami należącymi do królestwa grzybów Fungi. Różnią się one pod względem morfologicznym od innej grupy grzybów- pleśni, które posiadają budowę strzępkową.
Komórki drożdży posiadają typową budowę komórki eukariotycznej. W ich cytoplazmie występują takie organelle jak jądro komórkowe, mitochondria, rybosomy, retikulum endoplazmatyczne, aparat Golgiego czy rybosomy (Trojanowska, Giebel i Gołębiowska 2014).
Ściana komórkowa
Specyficzną cechą drożdży i innych grzybów jest budowa ściany komórkowej, ponieważ tylko w tym królestwie składa się ona z warstwy na współkrystalicznych włókien chityny, które zanurzone są w bezpostaciowej macierzy złożonej z β-glukanu. Oprócz polisacharydów w ścianie obecne są też białka. Wzrost następuje poprzez fuzję pęcherzyków z błoną komórkową. Plazmalemma zawiera aparat enzymatyczny pozwalający na rozluźnienie struktury ściany i polimeryzację ściany.
Aparat Golgiego jest odpowiedzialny za powstawanie pęcherzyków związanych z błoną cytoplazmatyczną. Po rozluźnieniu ściany zostaje ona rozciągnięta z powodu turgoru, a ostatecznie usztywniona (Nicklin, Graeme-Cook i Killington 2012).
Klasyfikacja
Dawniej grzyby były uznawane za grupę polifiletyczną, obejmującą organizmy różnego pochodzenia. Współcześnie stosuje się klasyfikację monofiletyczną, w której poszczególne grupy wywodzą się od wspólnego przodka. Na podstawie morfologii i sposobu rozmnażania płciowego grzyby dzieli się na 4-5 grup, a drożdże zalicza się do 2 z nich.
Grupa Ascomycota (workowce) cechuje się zdolnością do rozmnażania płciowego i bezpłciowego. W rozmnażaniu płciowym odbywa się za pośrednictwem askosporów, wytwarzanych w charakterystycznych workach (asci), a w przypadku rozmnażania bezpłciowego za pośrednictwem konidiosporów. Niektóre drożdże należą do grupy grzybów niedoskonałych Deuteromycota, które nie są zdolne do rozmnażania płciowego (Nicklin, Graeme-Cook i Killington 2012).
Drożdże właściwe zaliczane się do workowców, nibydrożdże należą do grzybów niedoskonałych. Lwia część drożdży należy do klasy workowców. Komórki drożdżowe mają okrągły, owalny, elipsoidalny, a niekiedy wydłużony kształt. Ich przeciętna wielkość waha się w granicach 4-6 µm. Wielkość i kształt komórek może być zmienny zależnie od środowiska i wieku. Interesującą grupą drożdży są grzyby drożdżoidalne, u których komórki po pączkowaniu nie rozdzielają się, lecz tworzą pseudogrzybnię.
Pączkowanie
Charakterystyczną formą rozmnażania się drożdży w stadium wegetatywnym jest pączkowanie. Niektóre gatunki tych grzybów (z klasy workowców) rozmnażają się poprzez rozszczepienie komórki. Podczas pączkowania na powierzchni komórki macierzystej powstaje uwypuklenie, które z czasem powiększa się, formując pączek. Pączek tworzy się w dowolnym miejscu na komórce kulistej, z kolei u komórki wydłużonej powstaje on w okolicy bieguna.
Jądro komórkowe dzieli się mitotycznie i jedno z jąder przechodzi do komórki potomnej z częścią cytoplazmy. Pączek stopniowo powiększa się, następnie oddziela od komórki macierzystej błoną cytoplazmatyczną i ścianą komórkową. Oddzielenie to nie zawsze jest natychmiastowe, obserwując drożdże pod mikroskopem, często można zobaczyć pączkujące drożdże. Przykładem drożdży rozszczepkowych jest rodzaj Schizosaccharomyces, ich sposób rozmnażania przypomina ten bakteryjny, z tą różnicą, że komórka potomna jest wyraźnie mniejsza od macierzystej. Gatunki drożdży należące do klasy workowców rozmnażają się płciowo rzadko, w niekorzystnych, głodowych warunkach środowiska.
Dzikie drożdże
Wśród drożdży wyróżnia się grupę dzikich drożdży. Są one powszechnie obecne na powierzchni warzyw, owoców, liściach drzew, w miodach i sokach, a także w produktach spożywczych. np. w wędlinach, czyli wszędzie gdzie są choć niewielkie ilości cukrów.
Hodowla drożdży
Drożdże można łatwo hodować w warunkach laboratoryjnych, jako medium wykorzystuje się pożywki z ekstraktem drożdżowym lub brzeczkę słodową. Komórki drożdży hodowane w warunkach przemysłowych najlepiej rosną w środowisku o pH 5-6. Temperatura 20-30°C jest optymalna dla wzrostu większości gatunków drożdży. Temperatura przekraczająca 70°C powoduje śmierć komórek. Niskie temperatury są dobrze znoszone przez te grzyby, przez co występują one często na produktach spożywczych przechowywanych w warunkach chłodniczych (Trojanowska, Giebel i Gołębiowska 2014).
Saccharomyces. Drożdże właściwe (szlachetne)
Rodzaj Saccharomyces ma największe znaczenie w praktyce przemysłowej i laboratoryjnej, określany jest też jako drożdże właściwe lub szlachetne. Drożdże, rosnąc na stałym podłożu, tworzą maziste i miękkie kolonie kremowej lub białej barwy. W płynnych pożywkach rosną w postaci osadu na dnie naczynia.
Podstawową formą rozmnażania tych drożdży jest pączkowanie, a w rozmnażaniu płciowym wytwarzają zarodnie w formie worków, zawierających po 1-2 zarodników. Najważniejszym przedstawicielem jest Saccharomyces cerevisiae, które mają szerokie zastosowanie w przemyśle spożywczym (browarnictwo, winiarstwo, piekarnictwo, gorzelnictwo) i produkcji biopaliw.
Pozostałe rodzaje drożdży workowych mają niewielkie znaczenie w działalności człowieka. Często stanowią one niepożądaną mikroflorę w przemyśle spożywczym i fermentacyjnym, a są to drożdże z rodzaju Pichia, Hansenula czy Debaromyces. Drożdże należące do grupy grzybów niedoskonałych nie zarodnikują. Przeważnie ich zdolności fermentacyjne są słabe, zaś produktami ich metabolizmu jest wiele produktów ubocznych. Są wśród nich gatunki kożuchujące, które tworzą naloty na powierzchni żywności. Niektóre z tych drożdży wykazują zdolność do gromadzenia znacznych ilości materiałów zapasowych- lipidów i białek, przez co wykorzystuje się je jako drożdże paszowe.
Drożdże Rhodotorula zawierają karotenoidy nadające im różową barwę. Do drożdży niezarodnikujących zalicza się rodzaje: Candida, Cryptococcus czy Torula (Trojanowska, Giebel i Gołębiowska 2014).
Czego potrzebują drożdże do rozwoju
Drożdże są organizmami heterotroficznymi. Źródłem energii i węgla dla komórek są związki organiczne, przede wszystkim węglowodany. Z powodu obecności sztywnej ściany komórkowej, uniemożliwiającej transport na drodze endocytozy węglowodany muszą być dostępne w formie rozpuszczonej. Metabolizm węglowodanów, podobnie w innych komórkach eukariotycznych następuje na drodze glikolizy i cyklu kwasu cytrynowego. Większość grzybów to organizmy tlenowe, ale drożdże wykazują zdolność do bytowania w warunkach o małej zawartości tlenu, a nawet jego absencji. W takim środowisku drożdże metabolizują węglowodany na drodze fermentacji.
Innym niezbędnym pierwiastkiem koniecznym komórkom drożdżowym do życia i rozwoju jest azot. Grzyby nie są zdolne do wiązania azotu atmosferycznego. Źródłem azotu dla nich są azotany, amoniak i wolne aminokwasy, transportowane bezpośrednio przez plazmalemmę.
Peptydy i białka, stanowiące bardziej złożone źródła tego pierwiastka wymagają obróbki proteolitycznej. Innymi pierwiastkami ważnymi w metabolizmie drożdży są: fosfor, wapń, potas, miedź, mangan, sód, cynk, żelazo, molibden, magnez i siarka. Zazwyczaj są one obecne w środowisku w nadmiarze, z wyjątkiem fosforu, którego może brakować zwłaszcza w glebach.
Komórki grzybów wymagają obecności wody do pobierania substancji odżywczych. Preferują też środowiska kwaśne, które są w stanie dodatkowo zakwaszać poprzez produkty swojego metabolizmu. Optymalne pH wynosi 4-6. W przypadku braku substancji odżywczych, obecności konkurencyjnych organizmów lub innych stresów metabolicznych komórki syntetyzują wtórne metabolity (Nicklin, Graeme-Cook i Killington 2012).
Wymagane środowisko
Dla wzrostu S. cerevisiae muszą być spełnione określone warunki środowiska. Wymagana jest wysoka aktywność wody, wynosząca nie mniej niż 0,65. Woda jest absolutnie niezbędna do fermentacji, podłoża bogate w cukry mogą powodować stres osmotyczny (zmniejszona dostępność wody), co negatywnie wpływa na fizjologię komórki.
Komórki drożdży reagują na niedostateczną ilość wody poprzez nadprodukcję glicerolu lub innych związków osmotycznie czynnych jak trehaloza, które chronią błony komórkowe przed osuszeniem. Związki te mogą zastąpić wodę w komórce, przewrócić jej objętość i umożliwić kontynuację przemian metabolicznych.
Drożdże S. cerevisiae rosną najlepiej w temperaturze 20-30°C i pH 4,5- 6,5. Drożdże S. pastorianus wymagają innych warunków- chłodniejszej temperatury 8-15°C. Fermentujące drożdże zakwaszają swoje środowisko w wyniku sekrecji protonów (pompy protonowe), sekrecji kwasów organicznych (octan, bursztynian), usuwanie czynników buforujących i wydzielanie dwutlenku węgla, który w środowisku wodnym tworzy słaby kwas węglowy.
Podłoża stosowane w produkcji etanolu, takie jak brzeczka słodowa, melasa, moszcz winny zawierają odpowiednią ilość nieorganicznych jonów dla wzrostu drożdży, ale niekiedy suplementacja może być wymagana, zwłaszcza w przypadku cynku. Cynk jest ważnym kofaktorem dla dehydrogenazy alkoholowej, ostatniego enzymu procesu fermentacji. Innym ważnym pierwiastkiem dla produkcji etanolu jest magnez. Węglowodany stosowane w produkcji napojów alkoholowych pochodzą od roślin bogatych w cukry lub skrobię. W tym drugim przypadku skrobia musi zostać zhydrolizowana do mono- i oligosacharydów dostępnych dla drożdży (Walker i Stewart 2016).
Podział drożdży ze względu na proces energotwórczy
Drożdże można podzielić ze względu na przeprowadzany proces energotwórczy związany z metabolizmem cukru na drożdże niefermentujące, fakultatywnie fermentujące i obligatoryjnie fermentujące.
Drożdże niefermentujące np. Rhodotorula posiadają wyłącznie tlenowy metabolizm i nie są zdolne do przeprowadzania fermentacji alkoholowej.
Drożdże fermentujące obligatoryjnie np. Candida slooffii są zdolne do metabolizowania glukozy tylko na drodze fermentacji.
Drożdże fermentujące fakultatywnie pozyskują energię w wyniku przemian tlenowych lub fermentacji, zależnie od warunków środowiskowych, przede wszystkim stężenia cukru i dostępności tlenu. Do tej grupy należy S. cerevisiae, Pichia jadinii i Candida utilis (Rodrigues, Ludovico i Leao 2005).
Metabolizm glukozy
Pierwszym krokiem w metabolizmie glukozy jest glikoliza, zwana szlakiem Embdema-Meyenhorda-Parnasa, który zachodzi w cytozolu. Proces polega na wewnątrzkomórkowej konwersji glukozy (i fruktozy) do pirogronianu, czemu towarzyszy synteza ATP i NADH. Najpierw, komórka transportuje heksozy do wnętrza na zasadzie dyfuzji ułatwionej, co nie wymaga nakładów energii.
Drożdże posiadają 7 transporterów glukozy (Sarris i Papanikolaou 2016). Glukoza w pierwszym etapie glikolizy zostaje ufosforylowana przez odpowiednią kinazę do glukozo-6-fosforanu, który jest następnie izomeryzowany do fruktozo-6-fosforanu.
Dalej fosfofruktokinaza fosforyluje ten związek do fruktozo-1,6-difosforanu. Zatem pierwsze etapy glikolizy wymagają zużycia energii, ponieważ donorem reszt fosforanowych jest adenozynotrifosforan (ATP). W dalszych reakcjach aktywność aldolazy, izomerazy triozofosforanowej, dehydrogenazy aldehydu 3-fosfoglicerynowego, kinazy fosfoglicerynianowej, fosfogliceromutazy, enolazy i kinazy pirogronianowej cząsteczka fruktozodifosforanu zostaje zmetabolizowana do 2 cząsteczek kwasu pirogronowego, zredukowania nośników wodoru NADH i powstania wysokoenergetycznych wiązań w formie ATP w wyniku fosforylacji substratowej.
Szlak glikolizy jest wspólny dla wszystkich drożdży, a regulacja metabolizmu węgla odbywa się na poziomie cyklu pentozofosforanowego. Ok. 50% glukozo-6-fosforanu jest metabolizowana w tym cyklu i 30% u drożdży, u których nie występuje efekt Crabtree (wyjaśnienie będzie w dalszej części artykułu). Jednakże 90% węgla przechodzącego przez cykl pentozofosforanowy powraca do szlaku glikolizy w postaci fruktozo-6-fosforanu lub aldehydu 3-fosfoglicerynowego.
Rozdział cząsteczek glukozy między glikolizą i cyklem pentozofosforanowym wydaje się odgrywać większą rolę w metabolizmie tego sacharydu u drożdży nie wykazujących efektu Crabtree niż u tych, u których zjawisko to występuje. Drożdże S. cerevisiae, u których występuje efekt Crabtree, wykazują małe natężenie przemian katabolicznych w cyklu pentozofosforanowym.
Kwas pirogronowy, będący końcowym produktem glikolizy może być włączony w różne szlaki metaboliczne zależnie od gatunku drożdży i warunków środowiskowych. Obieg węgla w komórce może zostać też rozdzielony między szlaki oddychania komórkowego i fermentacji. Pirogronian może zostać bezpośrednio przekształcony w acetylo-CoA (zwany też aktywnym octanem) przez mitochondrialny kompleks dehydrogenazy pirogronianowej (PDH), po jego przetransportowaniu do tego organellum przez odpowiedni nośnik.
Acetylo-CoA może powstać też w cytozolu, jest to proces pomijający PDH, ale wymagający aktywności innych enzymów: dekarboksylazy pirogronianowej (konwersja pirogronianu do aldehydu octowego), dehydrogenazy aldehydu octowego (konwersja aldehydu octowego do kwasu octowego) i syntetazy acetylo-CoA (konwersja octanu do acetylo-CoA). W tym szlaku acetylo-CoA powstaje w cytozolu, skąd jest transportowany do mitochondrium przez system acetylotransferazy karnitynowej. Mitochondrialny kompleks dehydrogenazy pirogronianowej wykazuje wyższe powinowactwo do kwasu pirogronowego niż dekarboksylaza pirogronianowa, w związku z czym większość pirogronianu zostaje przekształcona w acetylo-CoA przez PDH.
Jednakże w przypadku wysokiego stężenia glukozy tempo glikolizy wzrasta, wytwarzana jest większa ilość kwasu pirogronowego i zwiększa się udział szlaku syntezy acetylo-CoA z pominięciem PDH, zaś obieg węgla zostaje przekierowany w stronę fermentacji i produkcji etanolu.
Przy niskim stężeniu glukozy pirogronian jest przede wszystkim konwertowany do aktywnego octanu przez PDH. Z energetycznego punktu widzenia synteza acetylo-CoA z pominięciem PDH jest mniej korzystna, ponieważ syntetaza acetylo-CoA wymaga energii pochodzącej z hydrolizy ATP. Zatem stężenie glukozy wpływa na metabolizm glukozy w kierunku fermentacji lub oddychania komórkowego, zwłaszcza u S. cerevisiae (Rodrigues, Ludovico i Leao 2005).
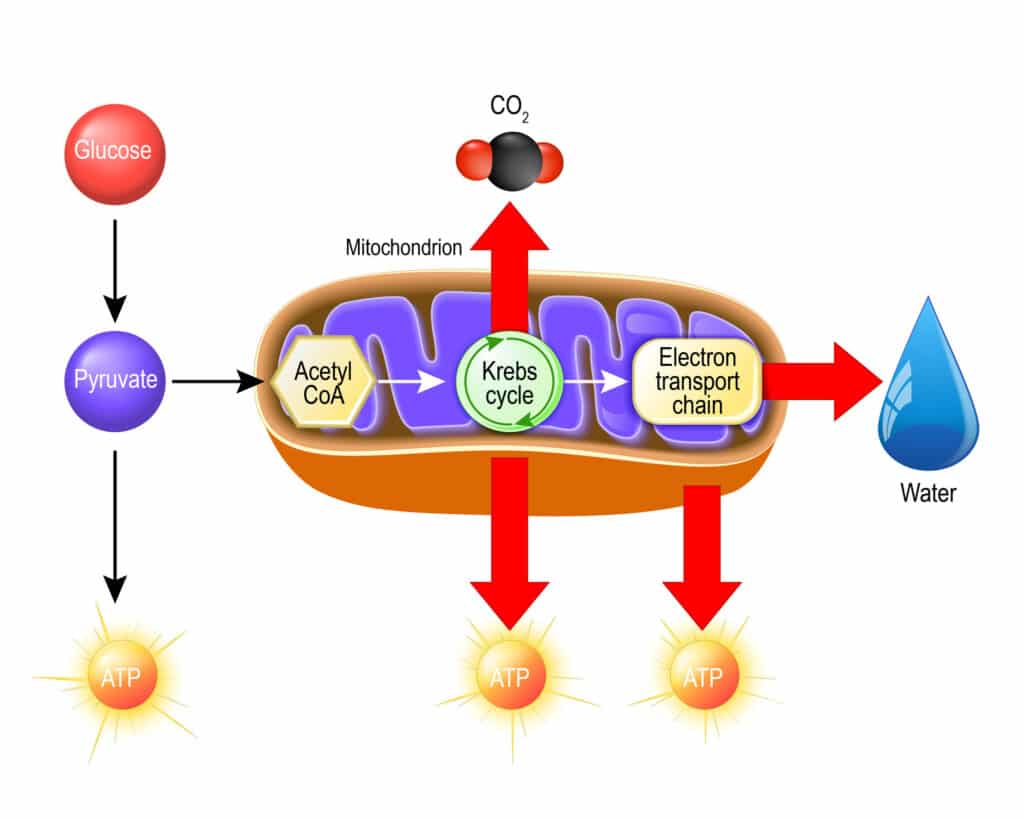
Aktywny octan zostaje włączony w cykl kwasów trikarboksylowych. Najważniejszą funkcją tego cyklu jest dostarczenie zredukowanych nośników do łańcucha oddechowego. Cykl Krebsa uczestniczy też pośrednio w reakcjach biosyntezy, ponieważ wszystkie związki pośrednie tego cyklu (oprócz izocytrynianu) mogą być wykorzystane w innych reakcjach metabolicznych. Pierwsza reakcja polega na kondensacji cytrynianu i aktywnego octanu w szczawiooctan, który zostaje następnie przekonwertowany do izocytrynianu.
W kolejnym etapie związek ten zostaje przekształcony przez dehydrogenazę izocytrynianową do α-ketoglutaranu poprzez oksydatywną dekarboksylację. Dalej dehydrogenaza α-ketoglutaranowa konwertuje ten związek do bursztyniano-CoA, a tiokinaza bursztynianowa konwertuje ten związek do bursztynianu, a dehydrogenaza bursztynianowa przekształca kwas bursztynowy do fumaranu, a fumaraza katalizuje konwersję tego kwasu do jabłczanu.
Dehydrogenaza jabłczanowa katalizuje ostatnią reakcję w cyklu kwasów trikarboksylowych, jaką jest utlenienie kwasu jabłkowego do szczawiooctowego. Cykl Krebsa może być kontrolowany na 2 etapach, na podstawie ograniczonej dostępności substratów substratów szczawiooctanu i α-ketoglutaranu. W komórkach S. cerevisiae synteza szczawiooctanu z pirogronianu obecnego w cytozolu katalizowana przez karboksylazę pirogronianową stanowi szlak anaplerotyczny (dopełniający) dla uzupełnienia ilości metabolitów pośrednich w cyklu Krebsa. Ograniczona dostępność tlenu powoduje zmiany w cyklu Krebsa, wówczas jest on przestawiony na produkcję szczawiooctanu i α-ketoglutaranu (Rodrigues, Ludovico i Leao 2005).
W warunkach tlenowych po cyklu Krebsa następuje w mitochondrium złożony proces zwany oksydacyjną fosforylacją, w którym synteza ATP jest dostosowana do zmian w zapotrzebowaniu energetycznym komórki i utrzymaniu wzrostu lub homeostazy. Podczas metabolizowania glukozy w warunkach tlenowych cytozolowy i mitochondrialny NADH zostaje ponownie utleniony w łańcuchu oddechowym. Osobliwą cechą drożdży S. cerevisiae jest brak kompleksu typu I dehydrogenazy NADH złożonej z wielu podjednostek. Zamiast tego, gatunek ten posiada oksydoreduktazę NADH: ubichinon, złożoną z 1 podjednostki, która pośredniczy w utlenianiu wewnątrzmitochondrialnego NADH w łańcuchu oddechowym.
Enzym ten katalizuje reakcję transferu 2 elektronów z wewnątrzmitochondrialnego NADH na ubichinon. Mitochondria komórek drożdżowych, podobnie jak roślinnych posiadają nie tylko wewnętrzną mitochondrialną dehydrogenazę NADH, ale też zewnętrzną mitochondrialną dehydrogenazę NADH. Wewnętrzna i zewnętrzna dehydrogenaza NADH nie pełnią funkcji pompy protonowej, przez co gatunek ten cechuje się niższym poziomem oksydatywnej fosforylacji. Zysk energetyczny uzyskany poprzez całkowite spalenie glukozy wynosi ok. 16 cząsteczek ATP- 2 cząsteczki od fosforylacji substratowej podczas glikolizy, 2 od GTP i 12 od oksydacyjnej fosforylacji.
Jest to ośmiokrotnie większa wydajność w porównaniu z fermentacją alkoholową. Innymi szczególnymi cechami łańcucha oddechowego drożdży jest to, że kompleksy bc1 i oksydazy cytochromowej c są złożone w duży „superkompleks”. Łańcuch oddechowy S. cerevisiae różni się od tego u innych grzybów i roślin tym, że dehydrogenaza NADH nie jest związana z pompą protonową, ale nie posiada też alternatywnej oksydazy niezależnej od cyjanków, która katalizuje reakcję bezpośredniego utleniania ubichinonu przez cząsteczkowy tlen.
W spoczynkowych komórkach S. cerevisiae tempo oksydacyjnej fosforylacji jest kontrolowane krótkoterminowo przez syntetazę ATP (zależność od obiegu ATP w cytozolu), a łańcuch oddechowy podlega kontroli przez zmniejszenie dostępności przenośników jonów wodoru, allerosterycznej aktywacji dehydrogenaz oraz przez zmiany przepuszczalności dla jonów wewnętrznej błony mitochondrialnej. Mitochondria, mimo że są odpowiedzialne za syntezę ATP, stanowią jednocześnie główne miejsce rozpraszania energii w metabolizmie tlenowym (Rodrigues, Ludovico i Leao 2005).
W komórkach drożdży istotną kwestią jest zachowanie równowagi oksydoredukcyjnej. Nukleotydowe nośniki NAD+/NADH i NADP+/NADPH odgrywają kluczową rolę w metabolizmie drożdży. NADH jest wykorzystywany w procesach katabolicznych, natomiast NADPH w procesach anabolicznych. Utrzymanie równowagi oksydoredukcyjnej jest konieczne dla żywych komórek w celu podtrzymania prawidłowego metabolizmu i wzrostu.
Ponieważ błony biologiczne są nieprzepuszczalne dla nukleotydów pirydynowych, celem utrzymania równowagi redox zredukowane nukleotydy muszą zostać ponownie utlenione w kompartmencie komórki, w którym zostały one wytworzone.
Cytozolowy NADPH powstaje podczas części oksydacyjnej szlaku pentozofosforanowego. Dehydrogenaza izocytrynianowa zależna od NADP+ i dehydrogenaza aldehydu octowego zależna od NADP+ też uczestniczą w redukcji tego nukleotydu. S. cerevisiae nie potrafią połączyć utleniania NADPH z łańcuchem oddechowym, przez co nukleotyd ten nie uczestniczy w procesach katabolicznych u tego gatunku, a zredukowany nukleotyd powstały w szlaku pentozofosforanowym wykorzystywany jest w procesach syntezy.
Również w przypadku procesów fermentacyjnych rola tego nośnika jonów wodorowych jest ograniczona, a dehydrogenaza alkoholowa jest ściśle zależna od NAD+. Z drugiej strony, drożdże Kluyveromyces lactis wykorzystują szlak pentozofosforanowy w katabolizmie glukozy, gdy przeprowadzenie glikolizy jest zablokowanie, co może sugerować, że utlenianie cytozolowego NADPH może być związane z łańcuchem oddechowym u tego gatunku.
Co ciekawe, u roślin nukleotyd ten jest wykorzystywany w łańcuchu oddechowym. Redukcja nukleotydu NAD+ zachodzi w cytozolu podczas glikolizy i w mitochondrium podczas cyklu Krebsa, w obu przypadkach jest to uwarunkowane poprzez aktywność odpowiednich dehydrogenaz. NADH powstający w obu reakcjach podlega oksydacji w mitochondrialnym łańcuchu oddechowym. Ostatecznym akceptorem elektronów jest tlen. Nadmiar powstającego w cytozolu NADH w warunkach tlenowych jest transportowany do mitochondrium dzięki aktywności zewnętrznej dehydrogenazy NADH (Rodrigues, Ludovico i Leao 2005).
Fermentacja alkoholowa
Słowo fermentacja ma etymologię łacińską i wywodzi się od słów: fervere, fermentatio i fermentum, oznaczających kipienie, gotowanie się, burzenie się, moszcz, zaczyn i kwaśne ciasto. Francuski uczony Ludwik Pasteur określił fermentację jako „życie bez tlenu”.
Czym jest fermentacja
Obecna definicja terminu fermentacja brzmi: energotwórczy proces utleniania substratu węglowego przez mikroorganizmy, w którym tlen nie jest akceptorem elektronów. Fermentację można też zdefiniować jako szereg przemian katabolicznych, które zachodzą w komórkach mikroorganizmów z udziałem enzymów, przez co substrat węglowy zostaje utleniony. Proces ten pozwala na uzyskanie energii potrzebnej drobnoustrojom do wzrostu i rozmnażania, ponadto powstają produkty uboczne, mogące być szkodliwe dla komórki. Ta szeroka definicja dotyczy procesów beztlenowych takich jak fermentacja alkoholowa i mlekowa, i tlenowych, jak fermentacja cytrynianowa i octanowa (Gawęcki i Libudzisz 2016).
Proces fermentacji alkoholowej
Wytworzone podczas glikolizy zredukowane nukleotydy NADH muszą zostać utlenione poprzez przeniesienie elektronów na akceptor celem regeneracji NAD+ zużytych podczas glikolizy. W przypadku S. cerevisiae i innych drożdży proces ten jest zwany fermentacją alkoholową. Zachodzi on w cytoplazmie, gdzie aldehyd octowy, zwany etanalem, będący produktem dekarboksylacji kwasu pirogronowego stanowi ostateczny akceptor elektronu.
W porównaniu do glikolizy, fermentacja etanolowa zawiera 2 dodatkowe reakcje enzymatyczne. Od cząsteczki pirogronianu zostaje odłączona cząsteczka CO2 (dzięki działaniu dekarboksylazy pirogronianowej), przez co powstaje aldehyd octowy. Kofaktorami tej reakcji są pirofosforan tiaminy i magnez. Następnie aldehyd octowy zostaje zredukowany do etanolu, co pozwala na regenerację NADH do NAD+. Enzymem katalizującym tą reakcję jest dehydrogenaza alkoholowa, a jej kofaktorem jest cynk.
W rezultacie, końcowymi produktami fermentacji alkoholowej są etanol i dwutlenek węgla, które opuszczają komórkę na drodze dyfuzji prostej. Jak wynika z powyższego opisu, głównym celem produkcji etanolu przez drożdże jest regeneracja NAD+. Cel ten może zostać osiągnięty również poprzez fermentację gliceropirogronianową, w której glicerol jest ostatecznym produktem.
Fosforan dihydroksyacetonu (główny produkt reakcji aldolazy) utlenia się do glicerolo-3-fosforanu (przez enzym dehydrogenazę glicerolo-3-fosforanu), podczas gdy cząsteczka NADH jest utleniana do NAD+. Następnie, enzym fosfataza glicerolo-3-fosforanowa katalizuje reakcję wytwarzania glicerolu przez defosforylację.
Produkcja glicerolu zużywa ATP, ale jest to konieczne dla kompensowania nierównowagi redoks w komórce. W początkowym etapie fermentacji, gdy drożdże wykazują silny wzrost, czemu towarzyszy synteza białek, lipidów i nukleotydów, fermentacja gliceropirogronianowa dominuje. Większość z wymienionych wyżej substancji jest syntetyzowana z pirogronianu.
Każdorazowo, gdy cząsteczka pirogronianu jest wykorzystana w procesie anabolicznym, powstaje deficyt NAD+, który musi zostać zniwelowany poprzez szlak gliceropirogronianowy. Z tego powodu glicerol jest produkowany w początkowym etapie fermentacji alkoholowej, gdy drożdże są jeszcze w stadium wzrostu, i potrzebują zwiększonej produkcji pirogronianu dla zwiększenia swojej biomasy.
Ponadto glicerol pełni funkcję ochronną przeciwko wysokiemu ciśnieniu osmotycznemu. Fermentacja gliceropirogronianowa może być procesem pożądanym lub niepożądanym. Stosuje się różne strategie modulowania produkcji glicerolu przez S. cerevisiae. Jedną z nich jest modyfikacja warunków fermentacji- poziom tlenu, dodatek witamin, warunki stresowe jak ciśnienie osmotyczne. Innym sposobem zmniejszenia lub zwiększenia produkcji glicerolu jest wykorzystanie szczepów modyfikowanych genetycznie (Sarris i Papanikolaou 2016).
Drożdże przeprowadzają fermentację alkoholową, w której substratem są cukry proste- glukoza, galaktoza, fruktoza i mannoza. Drożdże są też zdolne do fermentowania niektórych disacharydów- maltozy i sacharozy i trisacharydów- rafinozy, natomiast nie mogą wykorzystywać skrobi.
Drożdże górnej i dolnej fermentacji
Ze względu na sposób przeprowadzania fermentacji drożdże dzieli się na 2 grupy. Drożdże górnej fermentacji wykorzystują 1/3 dostępnej rafinozy, która zostaje zhydrolizowana do fruktozy i melibiozy, która nie jest dalej fermentowana. Drożdże dolnej fermentacji posiadają bogatszy aparat enzymatyczny, w tym α-galaktozydazę, dzięki czemu rafinoza zostaje całkowicie odfermentowana. W przemyśle wykorzystuje się głównie drożdże z rodzaju Saccharomyces, które określa się jako drożdże szlachetne.
Działanie drożdży
Gatunki drożdży wykorzystywane w przemyśle fermentacyjnym posiadają wiele szczepów o cechach pożądanych dla poszczególnych gałęzi tego przemysłu. Drożdże wykorzystywane przez człowieka odfermentowują ketozy, ale istnieją też gatunki zdolne do metabolizowania pentoz np. Pichia i Candina, a także laktozy np. Kluyveromyces marxianus. Niestety drożdże mogą mieć również negatywny wpływ na działalność człowieka (psucie żywności) i jego zdrowie (drożdżyce), np. Candida, Cryptococcus czy Trichosporon (Trojanowska, Giebel i Gołębiowska 2014).
Sposoby metabolizowania glukozy
Sposób metabolizowania glukozy przez drożdże jest zależny od warunków środowiskowych, które powodują w komórkach pewne zjawiska zwane efektami. Przy niskim stężeniu glukozy w podłożu drożdże S. cerevisiae mogą wykorzystywać glukozę na drodze oddechowej lub fermentacyjnej.
Efekt Pasteura
Obecność tlenu inicjuje łańcuch oddechowy i produkcję biomasy, ale jednocześnie obniża kinetykę fermentacji, a co za tym idzie produkcję etanolu. Przy niskim stężeniu tlenu zostaje ograniczona aktywność enzymów cyklu Krebsa i następuje wzrost aktywności kluczowych enzymów glikolizy (np. fosfofruktokinazy), przez co metabolizm komórki zostaje przekierowany na produkcję etanolu. Jest to tak zwany efekt Pasteura, jednakże nie wszystkie drożdże wykazują ten efekt.
Efekt Crabtree
Te gatunki, u których zjawisko to występuje, cechują się wstrzymaniem procesu fermentacji przy obecności tlenu. Gdy mikroorganizm zacznie metabolizować cukry, wytwarzane są duże ilości dwutlenku węgla, tlen zostaje wyparty i rozpoczyna się proces fermentacji. Jednakże nawet przy obecności tlenu , gdy stężenie cukru przekracza wartość krytyczną (9 g/l) oddychanie nie zachodzi, a komórka dalej przeprowadza fermentację. Jest to efekt Crabtree.
Przy wysokim stężeniu cukru mitochondria degenerują, proporcja błonowych steroli i kwasów tłuszczowych zmienia się, a enzymy zaangażowane w procesy tlenowe (enzymy cyklu Krebsa i łańcucha oddechowego) podlegają represji katabolicznej.
Wówczas metabolizm komórki jest nastawiony na produkcję etanolu, mimo obecności tlenu. Komórki drożdży potrzebują tlenu w pierwszych godzinach po inokulacji do pożywki. Etanol i dwutlenek węgla są głównymi produktami asymilacji glukozy w pierwszej fazie wzrostu w drodze fermentacji.
Jeśli nie ma cukrów w pożywce, a stężenie rozpuszczonego tlenu przekracza krytyczny poziom, to wówczas wcześniej wyprodukowany etanol jest jedynym źródłem węgla i służy jako substrat do dalszego wzrostu drożdży.
Podczas tego procesu obserwuje się zastój we wzroście drożdży, z powodu biosyntezy enzymów uczestniczących w glukoneogenezie. Drożdże Saccharomyces produkują etanol, który jest toksyczny dla większości drobnoustrojów, stanowiących konkurencję dla nich, a po „usunięciu” konkurencyjnych drobnoustrojów etanol może zostać wykorzystany jako źródło węgla.
Zdolność drożdży do produkcji etanolu
Zdolności drożdży do produkcji etanolu też nie są nieograniczone, ponieważ nadmierne stężenie tego związku negatywnie wpływa na metabolizm tych mikroorganizmów i ich żywotność. Zależnie od szczepu drożdże mogą tolerować stężenie alkoholu do 12%, z tym że szczepy piwne cechują się mniejszą tolerancją od winnych i gorzelniczych.
Dehydrogenaza alkoholowa katalizuje reakcję konwersji aldehydu octowego w etanol w obie strony. Efekt Kluyvera oznacza brak fermentacji alkoholowej w warunkach wzrostu, gdy dostęp do tlenu jest ograniczony, a źródłem węgla są dwucukry. To zjawisko wynika tego, że wzrost drożdży na niektórych sacharydach zachodzi tylko w warunkach tlenowych, mimo że drożdże mogą wykorzystywać różne rodzaje mono- i disacharydów w swoim metabolizmie. Efekt Custera oznacza zahamowanie procesu fermentacji w warunkach beztlenowych, co jest cechą charakterystyczną dla drożdży z rodzaju Dekkera i Brettanomyces. Drożdże te metabolizują glukozę w etanol i octan w warunkach tlenowych (Sarris i Papanikolaou 2016).
Gdy komórki S. cerevisiae są umieszczane w świeżej pożywce fermentacyjnej i inkubowane w warunkach optymalnych, kształtuje się typowa krzywa wzrostu, która obejmuje fazę zastoju (okres braku wzrostu, komórki adaptują się do nowego środowiska), fazę wzrostu wykładniczego i fazę stacjonarną. Podczas fermentacji okres maksymalnej przyswajalności cukru i produkcji alkoholu pokrywa się z fazą logarytmiczną. Szacuje się, że rosnące komórki drożdży produkują etanol 33 razy szybciej niż komórki nierosnące. Na podstawie obliczeń stechiometrycznych można stwierdzić, że ze 180 kg glukozy powstanie 92 kg etanolu i 88 kg dwutlenku węgla.
Więc teoretycznie na każdy kilogram glukozy przypada ok. 500 g etanolu. Jednak w przypadku fermentacji w warunkach przemysłowych najlepsza wydajność wynosi ok. 90% tej teoretycznej, ze względu na to, że część węgla jest kierowana do produkcji biomasy drożdży i syntezy pomniejszych metabolitów fermentacyjnych.
Metabolity wtórne
Do metabolitów wtórnych należą: wyższe alkohole, poliole, estry, kwasy organiczne, wicynalne diketony i aldehydy. Te metabolity, chociaż są wytwarzane przez drożdże w znacznie niższych stężeniach w porównaniu z etanolem i dwutlenkiem węgla, wpływają na cechy sensoryczne napojów alkoholowych. Głównymi wtórymi metabolitami fermentacji są glicerol i kwas bursztynowy.
Niektórzy winiarze uważają, że obecność gliceryny w winie nadaje „posmak w ustach” i lepkość. Glicerol jest metabolitem o największym stężeniu po etanolu i CO2. Bursztynian może być wytwarzany przez S. cerevisiae przy ograniczonej aktywności cyklu Krebsa, podczas gdy glicerol może być wytwarzany w reakcjach równoważenia redoks lub jako kompatybilna substancja produkowana w odpowiedzi na stres osmotyczny.
Jeśli chodzi o estry, związki te stanowią bardzo ważną grupę związków smakowo-zapachowych, które nadają pożądane owocowo-kwiatowe posmaki i aromaty w napojach fermentowanych. Większość z nich jest wytwarzana podczas fermentacji w reakcjach między alkoholami i acylo-CoA, ale niektóre estry np. mleczan etylu, są związane z kontaminacją bakteryjną (np. Lactobacillus).
Octan izoamylu jest produkowany w niższych stężeniach, ale ponieważ ma znacznie niższy próg smakowy, stanowi znaczący składnik aromatu napoju. Diacetyl jest wicynalnym diketonem wytwarzanym w wyniku reakcji będącej odgałęzieniem procesu syntezy waliny. Obecność diacetylu, szczególnie w piwie typu lager, jest niepożądana, ponieważ powoduje zapach zjełczałego masła. Produkcja wyższych alkoholi lub olejów fuzlowych podczas fermentacji następuje po deaminacji i dekarboksylacji aminokwasów w wyniku szlaku Ehrlicha- drogi katabolicznej, występującej, gdy w pożywce jest nadmiar aminokwasów. W przypadku niedoboru aminokwasów wyższe alkohole powstają ze związków pośrednich α-ketokwasów. Wyższe temperatury fermentacji sprzyjają zwiększonej produkcji olejów fuzlowych (Walker i Stewart 2016).
Przemysł fermentacyjny
Człowiek od tysiącleci wykorzystuje drobnoustroje w produkcji fermentowanej żywności, choć większość tego okresu fermentacja była przeprowadzana w sposób przypadkowy i spontaniczny, a stosowana mikroflora pochodziła z surowca lub otoczenia.
Choć rozwój naukowy i technologiczny pozwala dzisiaj na przeprowadzanie tego procesu w sposób kontrolowany, to tradycyjne sposoby fermentacji wciąż są stosowane w domowej produkcji mlecznych napojów fermentowanych i kiszonek, a także niektórych gatunków wina czy piwa.
Kultury starterowe
W przemyśle fermentacyjnym wykorzystuje się przemysłowe szczepy mikroorganizmów w postaci, tak zwanych kultur starterowych, szczepionek czy zakwasów. Szczepy te pochodzą głównie ze środowiska naturalnego, skąd je wyizolowano i poddano selekcji ze względu na możliwość wykorzystania w warunkach przemysłowych.
Stosowane są kultury czyste i mieszane. Te pierwsze wywodzą się z rozmnożenia 1 komórki, a więc są jednolite genetycznie. Wykorzystuje się je w procesach nastawionych na otrzymanie 1 produktu lub osiągnięcie jego dominacji w produkcie.
Natomiast kultury mieszane stanowią mieszaninę różnych szczepów 1 gatunku, mieszaninę różnych gatunków, a nawet rodzajów. Stosuje się je w produkcji mlecznych napojów fermentowanych, serów, kiszonek.
Mikroorganizmy, żeby mogły być wykorzystane w warunkach przemysłowych, muszą spełniać określone wymagania.
Przede wszystkim musi być udokumentowane ich bezpieczeństwo dla zdrowia człowieka, nie powinny być szkodliwe dla środowiska, a zwłaszcza roślin i zwierząt. Od strony praktycznej, istotnymi kwestiami są przechowywanie mikroorganizmów i forma, w jakiej są one zadawane.
Długotrwałe przechowywane nie może negatywnie wpłynąć na przeżywalność i stabilność genetyczną. Współcześnie wykorzystuje się takie metody przechowywania jak: zamrażanie w temperaturze -70°C lub -196°C, liofilizacja czy suszenie rozpyłowe.
Drobnoustroje przechowuje się w postaci zawiesiny komórek z dodatkiem substancji ochronnych. Kultury starterowe wprowadza się do procesu w formie płynnej zawiesiny namnożonych komórek, a ich liczebność musi gwarantować efektywny i szybki przebieg określonego procesu. Stosuje się też szczepionki mrożone i suszone. W szczepionce znajduje się znaczna liczba komórek, wynosząca 109- 1011 komórek/ gram (Gawęcki i Libudzisz 2016).

Drożdże winiarskie
Winiarstwo
Wino to napój cechujący się niską lub średnią zawartością alkoholu. Surowcem do jego produkcji jest miazga lub sok świeżych winogron, lub innych owoców. W ten sposób produkuje się wina gronowe lub wina owocowe. Wina gronowe są najważniejszą grupą win.
Wśród win można wyróżnić wina lekkie (10% alkoholu), średnio mocne (10-14%), mocne (14-18%) i alkoholizowane (ponad 18%). Wina mogą się różnić pod względem zawartości cukru (wytrawne, półwytrawne, półsłodkie, słodkie, bardzo słodkie, likierowe) i barwy (białe, czerwone, różowe).
Produkcja wina
Produkcję wina można podzielić na 3 etapy: przygotowanie surowca do fermentacji, fermentacja miazgi lub moszczu, leżakowanie i czynności końcowe. Winogrona i inne owoce zawierają cukry w formie przyswajalnej dla drożdży, więc przygotowanie surowca jest znacznie prostsze niż w przypadku browarnictwa. Sprowadza się ono do wydobycia tych sacharydów z miazgi owocowej w postaci moszczu- surowego soku owocowego. Moszcz można otrzymać na wiele sposobów:
- natychmiastowe tłoczenie
- miażdżenie gron i tłoczenie/ miażdżenie
- maceracja przez 12-48 godzin i tłoczenie
Po etapie tłoczenia surowy sok jest wychładzany, siarkowany i filtrowany. Wina białe otrzymuje się w wyniku rozdrobnienia winogron, wytłoczeniu miazgi i fermentowaniu soku. W przypadku win czerwonych w miazdze przeprowadza się wstępną fermentację, dzięki czemu czerwone barwniki ze skórki przechodzą do soku. Wina różowe można uzyskać poprzez tłoczenie winogron czerwonych bez wstępnej fermentacji miazgi. Następnie moszcz jest przenoszony do tanków fermentacyjnych.
Fermentacja w winiarstwie
W winiarstwie fermentacja może odbywać się przy udziale drożdży obecnych na powierzchni owoców lub w otoczeniu, a w części winiarni wykorzystuje się szczepionki drożdży winiarskich z gatunków S. cerevisiae lub S. bayanus. Istnieją szczepy drożdży winiarskich np. Cabernet, Bordeaux, Malaga, które są stosowane w produkcji określonego gatunku wina lub wykorzystuje się je w określonym regionie. Temperatura, w której przeprowadza się proces fermentacji, jest dostosowana do rodzaju wina. Białe wina fermentują w temperaturze do 18°C, a wina czerwone do 27°C.
Etap fermentacji trwa od kilku dni do kilku tygodni i jest on zależny od mocy wina, jaką winiarz chce uzyskać, i składa się on z 3 faz: zafermentowania, burzliwej fermentacji i dofermentowania. Gdy proces fermentacji zostaje zakończony, drożdże opadają na dno zbiornika, a wino jest przekazywane do zbiorników leżakowych, gdzie wino dojrzewa przez co najmniej rok. Jednakże w wielu państwach istnieje zwyczaj spożywania młodego wina podczas święta winobrania. Proces leżakowania trwa 2-3 lata dla win lekkich, a przy winach ciężkich znacznie dłużej. Po zakończeniu leżakowania wykonuje się zabiegi końcowe obejmujące klarowanie, stabilizację, pasteryzację i wychładzanie.
Poza winami naturalnymi istnieją także wina specjalne np. wina musujące. W produkcji stosuje się podwójny proces fermentacji. Pierwsza odbywa się w zbiornikach fermentacyjnych, a druga w specjalnych zamkniętych butelkach lub hermetycznych zbiornikach. Rezultatem drugiej fermentacji jest wysycenie wina dwutlenkiem węgla.
W Polsce popularne są wina owocowe, w których surowcem są porzeczki, jabłka, truskawki czy wiśnie. Ze względu na niską zawartość cukru i znaczną kwasowość moszcz musi być rozcieńczony i dosłodzony (Flaczyk, Górecka, Korczak 2011, Gawęcki i Libudzisz 2016).
Drożdże gorzelnicze
Gorzelnictwo
Gorzelnictwo to gałąź przemysłu zajmująca się produkcją etanolu w wyniku fermentacji i pozyskania z mieszaniny pofermentacyjnej spirytusu- wysokoprocentowego roztworu etanolu. Gorzelnie mogą być rolnicze, w których niewielkie gorzelnie wytwarzają spirytus z zboża i ziemniaków, i przemysłowe, wykorzystujące jako surowiec kukurydzę, melasę lub trzcinę cukrową. Wyróżnia się 3 grupy surowców stosowanych w gorzelnictwie:
- surowce cukrowe- buraki cukrowe, owoce, melasa, trzcina cukrowa
- surowce skrobiowe- zboża, ziemniaki, kassawa, maniok
- surowce celulozowe i hemicelulozowe- słoma, odpady przemysłu drzewnego, papierniczego i spożywczego
Produkcja etanolu
Pierwszym etapem w produkcji etanolu jest przeprowadzenie skrobi nierozpuszczalnej do rozpuszczalnej w wodzie. W gorzelniach rolniczych skrobia jest kleikowana przy pomocy ciśnieniowej metody periodycznej w parniku Henzego. Proces ten musi odbywać się w odpowiedniej temperaturze, wymagany jest także określony stosunek wody do skrobi.
Parowanie odbywa się w temperaturze 140°C pod ciśnieniem 0,4 MPa i trwa ok. 60 min. Prawidłowy stosunek wody do skrobi to 4:1. Oprócz upłynnienia skrobi, w etapie parowania dochodzi do wysterylizowania surowca, a także rozgotowania i ujednolicenia rozgotowanej masy surowca.
W bardziej zmodernizowanych gorzelniach kleikowanie skrobi przeprowadza się poprzez mechaniczne rozdrobnienie surowca i upłynnianie skrobi w warunkach bezciśnieniowych. Po zakończeniu procesu upłynniania skrobia zostaje poddana enzymatycznej hydrolizie w procesie zacierania, które zachodzi w temperaturach 80°C potem 55°C.
W procesie tym wykorzystuje się enzymy amylolityczne, które mogą pochodzić ze słodu gorzelniczego, ale przeważnie stosuje się preparaty enzymatyczne pochodzenia mikrobiologicznego. Otrzymany zacier jest słodki i bogaty w cukry przyswajalne dla drożdży. Kolejnym etapem jest fermentacja, przeprowadzana w zamkniętych zbiornikach fermentacyjnych.
Gatunki drożdży gorzelniczych
Gatunkiem drożdży przeprowadzającym proces fermentacji w gorzelniach jest S. cerevisiae, a szczepy tego gatunku muszą cechować się znaczną homofermentatywnością (wytwarzać niewielkie ilości produktów ubocznych), tolerancją na ciepło i odpornością na wyższe stężenia etanolu.
Drożdże mogą być zadane do zacieru w 2 postaciach: jako matka drożdżowa, powstałej w wyniku propagacji szczepu lub kultury starterowej suszonej rozpyłowo.
Proces produkcji etanolu
Podobnie jak w przypadku produkcji wina fermentacja dzieli się na 3 etapy: zafermentowanie, burzliwą fermentację i dofermentowanie. Etap fermentacji trwa zazwyczaj 2-3 doby. Temperatura jest dostosowana do zastosowanego szczepu drożdży, jednakże w fazie fermentacji burzliwej powinna odpowiadać maksymalnej temperaturze wzrostu danego szczepu, czyli zazwyczaj 30-36°C.
Fermentacja jest procesem egzotermicznym, a z powodu braku termoregulacji w wielu kadziach fermentacyjnych początkowa temperatura musi być niższa (18-25°C). Odfermentowany zacier zostaje poddany destylacji. Odpęd spirytusu polega na wielokrotnej destylacji zacieru, przez co otrzymuje się spirytus surowy (destylat) i wywar (ciecz wyczerpana).
Surowy spirytus zawiera 88-92% etanolu, a także aldehydy, ketony, metanol, estry, wyższe alkohole i kwasy organiczne. W skład wywaru wchodzi przede wszystkim woda, a także nieprzefermentowane elementy surowca, czyli celuloza, białko i składniki mineralne. Wywar może być wykorzystany jako pasza.
Kolejnym etapem jest dalsze oczyszczanie spirytusu surowego w procesie rektyfikacji. Surowy spirytus może zostać wykorzystany w produkcji wysokoprocentowych napojów alkoholowych np. wódki, whisky czy rumu (Flaczyk, Górecka, Korczak 2011, Gawęcki i Libudzisz 2016).
Bibrownictwo
Bimber jest wysokoprocentowym napojem alkoholowym wytwarzanym w warunkach domowych. Istnieje wiele receptur na przygotowanie bimbru z zbóż, ziemniaków, owoców czy cukru.
Poniżej zostanie zamieszczony przykładowy przepis na bimber z ziemniaków. Pierwszym krokiem jest utarcie 5 kg ziemniaków. Następnie przenosi się ziemniaki do dużego garnka i zalewa 5 l wody o temperaturze 65-70°C.
Kolejnym etapem jest dodanie 250 g pokruszonego słodu. Mieszaninę należy wymieszać, przykryć ręcznikiem i pozostawić na godzinę. W tym etapie enzymy pochodzące od słodu rozkładają skrobię ziemniaczaną do cukrów prostych. Po tym czasie trzeba schłodzić mieszaninę do 30°C i spuścić część płynną do zbiornika fermentacyjnego. Pozostałą masę trzeba rozcieńczyć poprzez dodanie 3 l wody. Mieszaninę należy ogrzać do 50°C i zlać część ciekłą do zbiornika fermentacyjnego. 25 g drożdży należy rozpuścić w wodzie i dodać do powstałej brzeczki.
Fermentację przeprowadza się w temperaturze 16-28°C przez 3-10 dni. Gdy dwutlenek węgla przestanie się wydzielać, można przystąpić do destylacji.
Bioetanol
Bioetanol jest odpowiednikiem benzyny, który można wykorzystać jako paliwo w transporcie. Produkcja bioetanolu może pozwolić na ograniczenie zużycia ropy i zanieczyszczenia środowiska. Dobrym materiałem do produkcji bioetanolu są odpadki rolnicze takie jak słoma kukurydziana i pszeniczna oraz drewno.
Produkcja bioetanolu
Produkcja bioetanolu ze skrobi przebiega w trzech etapach: hydroliza skrobi do monosacharydów, fermentacja glukozy do etanolu oraz dwutlenku węgla, separacja lub oczyszczanie produktu. Hydroliza pozwala na rozpad polimeru na cukry monomeryczne. Hydrolizę skrobi można przeprowadzić chemicznie za pomocą kwasu solnego czy siarkowego lub enzymatycznie przez amylazy.
Współczesne osiągnięcia w dziedzinie biotechnologii umożliwiły udoskonalenie procesu produkcji bioetanolu poprzez zwiększenie produktywności zmodyfikowanej genetycznie kukurydzy, czego rezultatem jest redukcja kosztów produkcji surowca. Skrobia z kukurydzy modyfikowanej genetycznie jest bardziej podatna na enzymatyczną hydrolizę. Amylazy są stosowane jako katalizatory tego procesu z powodu swej specyficzności i braku wtórnych reakcji. Po hydrolizie materiału skrobiowego przystępuje się do przeprowadzenia fermentacji.
Możliwa jest także produkcja etanolu z surowców nieskrobiowych takich jak pentozy czy celuloza. Dzikie szczepy S. cerevisiae nie metabolizują ksylozy. Stosuje się dwa sposoby zwiększenia efektywności fermentacji cukrów: nadanie drożdżom zdolności metabolizowania pentoz przy pomocy inżynierii genetycznej lub poprawa wydajności produkcji etanolu za pomocą inżynierii genetycznej w mikroorganizmach, które mają zdolność do fermentacji zarówno heksoz, jak i pentoz.
Pentozy są fermentowane do etanolu przez kilka dzikich gatunków (np. Schizosaccharomyces pombe, Saccharomyces amucae i Kluveromyces lactis) i zwykle z małą wydajnością. Poprzez modyfikację genetyczną otrzymano szczepy drożdży zdolne do fermentacji pentoz do etanolu.
Proces produkcji bioetanolu
Produkcja bioetanolu z lignocelulozy przebiega w czterech etapach: obróbka wstępna, hydroliza, fermentacja, separacja lub oczyszczanie. Proces produkcji etanolu z lignocelulozy do bioetanolu jest znacznie trudniejszy niż ze skrobi czy cukrów prostych. Wymagane jest przeprowadzenie obróbki wstępnej celem zniszczenia struktury komórkowej. Obróbka wstępna powinna spełniać określone kryteria takie jak:
- efektywne otrzymanie cukrów
- brak degradacji i strat węglowodanów
- brak tworzenia się produktów hamujących późniejsze procesy hydrolizy i fermentacji
- opłacalność całego procesu.
Do wstępnej obróbki biomasy lignocelulozowej stosowane są procesy fizyczne, fizykochemiczne, chemiczne i biologiczne. Wstępna obróbka polega na przeprowadzeniu hydrolizy enzymatycznej w celu usunięcia ligniny i hemicelulozy z biomasy lignocelulozowej, zmniejszenia krystaliczności celulozy i zwiększenia porowatości materiału. Do rozbicia polisacharydów często stosuje się chemiczną hydrolizę.
Chemiczna obróbka wstępna
Chemiczna obróbka wstępna może być przeprowadzona na wiele sposobów. Obejmuje ona ozonolizę, hydrolizę kwasową, hydrolizę zasadową, delignifikację oksydacyjną. Kwasy nieorganiczne są stosowane w hydrolizie chemicznej, ukierunkowane są one głównie na hemicelulozy i ligninę, rozpuszczając znaczną część tych składników i poprawia dostępność enzymów do celulozy.
Hydroliza kwasowa
Jednakże, w trakcie tego procesu powstaje kilka produktów ubocznych świadczących o degradacji węglowodanów, m.in. furfural, 5-hydroksymetylofurfural, kwasy fenolowe, aldehydy, kwas lewulinowy i inne kwasy alifatyczne, które mogą hamować zarówno hydrolizę enzymatyczną, jak i fermentację. Kwasowa hydroliza jest jedną z najstarszych i najczęściej stosowanych metod rozpadu lignocelulozy do cukrów fermentowalnych.
Istnieją dwa podstawowe rodzaje hydrolizy kwasowej: rozcieńczona i stężona. Zarówno proces stężonej, jak i rozcieńczonej hydrolizy kwasem siarkowym zachodzi w wysokich temperaturach (100 i 222°C). Takie warunki mogą spowodować degradację cukrów, zmniejszając ilość źródła węgla i ostatecznie zmniejszając wydajność produkcji bioetanolu.
Przeprowadzenie kwasowej hydrolizy wymaga zneutralizowania pH, dzięki czemu można w kolejnym etapie przeprowadzić enzymatyczny proces hydrolizy lub fermentacji. Pełna i szybka przemiana celulozy w glukozę i hemicelulozy w pentozy jest możliwa przy niewielkiej degradacji przy użyciu wstępnej obróbki stężonym kwasem siarkowym.
Hydroliza alkaliczna
Hydroliza alkaliczna wykorzystuje tlenek wapnia, amoniak i wodorotlenek sodu do rozkładu głównie hemicelulozy. Hydroliza alkaliczna jest reakcją zmydlania międzycząsteczkowych wiązań estrowych sieciujących hemicelulozy ksylanowe i inne składniki (np. ligninę).
Rozerwanie wiązań zwiększa porowatość lignocelulozy. Obróbka wstępna rozcieńczonym NaOH powoduje pęcznienie i prowadzi do zwiększenia wewnętrznego pola powierzchni, spadku stopnia polimeryzacji, spadku krystaliczności, naruszenia strukturalnych powiązań między ligniną a węglowodanami.
Istnieją również biologiczne metody wstępnej obróbki materiału lignocelulozowego, wykorzystujące grzyby białej i miękkiej zgnilizny zdolnych do rozkładu celulozy. Bioetanol może być stosowany jako czyste paliwo lub jako mieszanka paliwowa, które mogłyby zastąpić konwencjonalne paliwa silnikowe (Zabochnicka-Świątek i Sławik 2010).
Jedną z gałęzi przemysłu fermentacyjnego jest piwowarstwo, jednakże temat ten został już szczegółowo opisany w artykułach „Piwo- historia, produkcja, rodzaje, wartości odżywcze” i „Historia piwa„, w związku z tym nie będzie on podejmowany w tym artykule.
Podsumowanie
Podsumowując, drożdże mimo swojej prostej morfologii wykazują ciekawy i złożony metabolizm, na który wpływa wiele czynników. Uzyskanie wysokiej efektywności produkcji etanolu z pewnością stanowi wyzwanie dla pracowników przemysłu fermentacyjnego.
Literatura:
- Flaczyk E., Górecka D., Korczak J. (red.) (2011) Towaroznawstwo żywności pochodzenia roślinnego. Warszawa: Wydawnictwo Naukowe PWN, s. 321-370
- Gawęcki J., Libudzisz Z. (2016) (red.) Mikroorganizmy w żywności i żywieniu. Poznań: Wydawnictwo Uniwersytetu Przyrodniczego w Poznaniu, s. 41-53
- https://pl.alcheek.com/1118985-#menu-2
- Nicklin J., Graeme-Cook K., Killington R. (2012) Mikrobiologia. Krótkie wykłady. Warszawa: Wydawnictwo Naukowe PWN, s. 219-238
- Trojanowska K., Giebel H., Gołębiowska B. (2014) Mikrobiologia Żywności. Poznań: Wydawnictwo Uniwersytetu Przyrodniczego w Poznaniu, s. 77-88
- Rodrigues F., Ludovico P., Leao C. (2005) Sugar Metabolism in Yeasts: an Overview of Aerobic and Anaerobic Glucose Catabolism. Pobrano z: https://www.researchgate.net/publication/226259782https://www.researchgate.net/publication/226259782 (03.2006)
- Sarris D., Papanikolaou S. (2016) Biotechnological production of ethanol: Biochemistry, processes and technologies. Engeeniring in Life Science, 16, s, 307–329
- Walker M.W., Stewart G.G. (2016) Saccharomyces cerevisiae in the Production of Fermented Beverages. Beverages, 2 (30), s. 1-12
- Zabochnicka-Świątek M., Sławik L.(2010) Bioethanol – Production and Utilization. Archivum Combustionis, 30 (3), s. 237- 246
Biolog, student dietetyki, pracownik Centrum Badawczo- Rozwojowego firmy BGW sp. z.o.o.