Streszczenie:
Trawienie, przyswajanie składników odżywczych i witamin oraz obrona przed infekcjami są złożonym procesem układu trawiennego, w którym niezwykle istotną rolę odgrywają symbiotyczne bakterie jelitowe. Ich wpływ na nasz system immunologiczny i nasze zdrowie ma kluczowe znaczenie. Zakłócenie mikroflory jelitowej, określane również mianem dysbiozy, sprzyja osiedlaniu się patogennych mikroorganizmów i ma bezpośredni związek z zaburzoną przemianą materii oraz szeregiem chorób. Skutkować to może nadwagą, alergią pokarmową, przewlekłym zapaleniem jelit a nawet zaburzeniami rozwoju takimi jak autyzm.
Ewolucja już przed 500 milionami lat poradziła sobie z pierwszymi formami systemu trawiennego i tym samym z biologicznym siedliskiem dla ogromnej liczby mikroorganizmów. Bakterie te, stanowiące ok.1-2 kg wagi naszego ciała, są specjalnie dostosowane do otoczenia i wpływają przez swój metabolizm nie tylko na nasze trawienie, ale również na nasz układ odpornościowy. Większość symbiotycznych bakterii jelitowych i ich wzajemne oddziaływanie z naszym układem immunologicznym pozostawało przez długi czas niezbadane – głównie dlatego, że nie powodowało to żadnych chorób. Przypuszczalnie także z tego powodu nie wydawało się to istotne z punktu widzenia nauki. Nie bez znaczenia jest fakt, że w ciągu ostatnich lat, przez nieodpowiednie stosowanie antybiotyków pogląd ten się zmienił i zostało przeprowadzonych szereg badań naukowych na ten temat (1). W niniejszym artykule chcielibyśmy pokazać wzajemny wpływ mikroflory jelitowej i systemu odpornościowego.
Dwa najważniejsze zadania tego współdziałania to:
- ochrona przed patogennymi mikroorganizmami oraz jednoczesna
- tolerancja dla nieszkodliwych składników pokarmowych
Aby zrozumieć mechanizmy leżące u podstaw tej współpracy, należy najpierw poznać strukturę i składniki układu odpornościowego jelit. Przy czym trzeba podkreślić, że posiada on pewną autonomię i nie powinno się go utożsamiać z systemowym układem immunologicznym.
Jak jest zbudowany nasz układ immunologiczny w jelitach?
Powierzchniowa warstwa nabłonka jelitowego jest zaraz obok naszej skóry najważniejszą barierą, która zapobiega przedostawaniu się bakterii do głębszych warstw organizmu. Komórki kubkowe znajdujące się wewnątrz tej warstwy produkują wydzielinę, w której skład wchodzą tzw. mucyny. Określane jako Muc 1 i Muc 2 glikoproteiny, odporne na endogenne enzymy trawienne takie jak trypsyna, formują warstwę śluzową o grubości ok. 50μm, która zwilża śluzówkę jelita i chroni tkankę nabłonkową przed bezpośrednim kontaktem z patogennymi czynnikami zakaźnymi. Podczas gdy jedynie nieliczne patogenne mikroorganizmy są w stanie przedostać się przez warstwę śluzu, niektóre z nieszkodliwych bakterii symbiotycznych mogą przekraczać warstwę zewnętrzną a nawet indukować wytwarzanie śluzu z komórek kubkowych. W ten sposób, obok klasycznej funkcji obronnej wspierają również tolerancję dla nieszkodliwych składników pokarmowych, minimalizując ryzyko mechanicznych mikro-uszkodzeń, a tym samym zapobiegając procesom zapalnym (2).
Mucyny warstwy śluzowej działają także poprzez wzajemne oddziaływanie molekularne bezpośrednio na głębsze komórki tkanki nabłonkowej jelita i specjalne komórki systemu immunologicznego, tzw. komórki prezentujące antygen.
Przyjaciel czy wróg?
Komórki tkanki nabłonkowej jelita i komórki prezentujące antygen śluzówki jelita w procesie fagocytozy wchłaniają nieszkodliwe składniki pokarmowe jak również patogenne mikroorganizmy do wnętrza komórki, gdzie są dalej rozdrabniane (3). Powstające w ten sposób części składowe białek, określane jako antygeny, są następnie prezentowane przez te dwa typy komórek na ich powierzchni. Tam określone komórki efektorowe sprawdzają czy w naszym adaptatywnym systemie immunologicznym w prezentowanych antygenach znajdują się molekuły egzogenne, tj.pochodzące spoza naszego organizmu, które potencjalnie mogą pochodzić z patogennych zarazków. Owe komórki efektorowe to limfocyty T. W jaki sposób limfocyty T rozpoznają, czy prezentowane składniki są częścią niebezpiecznych zarazków czy jedynie składnikami pokarmowymi? Obie substancje są zupełnie obce naszemu układowi odpornościowemu. Kluczową rolę odgrywają tu tzw. toll-like receptory (TLR). Receptory te są częścią systemu immunologicznego i nie występują jedynie w komórkach prezentujących antygen, lecz również w komórkach tkanki nabłonkowej jelita. Rozpoznają strukturę lub wzór, który wiele patogennych mikroorganizmów ma wspólny, jak na przykład: lipopolisacharydy (TLR4) – część membrany wszystkich bakterii gram-ujemnych; flagelinę (TLR5) – część wici bakteryjnej itd. Tylko wtedy, gdy wspomniane toll-like receptory w komórkach tkanki nabłonkowej jelita czy komórkach prezentujących antygen zostaną aktywowane przez wzór patogenny, powyższe komórki poprzez limfocyty T mogą aktywować adaptatywny system immunologiczny. Dzięki temu nie dojdzie do sytuacji, w której na przykład białko przyjmowane z pożywienia wywoła adaptatywną reakcję odpornościową, ponieważ składniki pokarmowe z zasady takiego patogennego wzoru nie zawierają. Dodatkowo ważną rolę odgrywa tu także budowa tkanki nabłonkowej jelita. Receptory TLR5 nie występują na jego powierzchni w świetle jelita, ponieważ są tam duże ilości pożytecznych bakterii jelitowych posiadających wici, lecz tylko od strony podstawy nabłonka jelitowego. Niewskazana tu aktywacja adaptatywnego systemu immunologicznego jest więc uniemożliwiona. Tylko wtedy, gdy bariera tkanki nabłonkowej jelita zostaje pokonana, dochodzi do szybkiej aktywizacji systemu immunologicznego (4). Aktywowane receptory TLR5 pobudzają nie tylko limfocyty T, ale również same komórki tkanki nabłonkowej jelita. Uwalniane wówczas defensyny i lektyny typu C uszkadzają ściany komórkowe bakterii niszcząc je. Poprzez toll-like receptory obok limfocytów T, są również aktywowane limfocyty B. Znajdują się one wzdłuż całego jelita cienkiego w spójnych grudkach chłonnych, tzw. kępkach Peyera. Wytwarzają one przeciwciała IgA, które znacząco przyczyniają się do ochrony powierzchni błony śluzowej jelita. Opisane wyżej mechanizmy są tylko przykładem bardzo złożonych procesów molekularnych i komórkowych, które regulują współpracę mikroflory jelitowej oraz systemu immunologicznego. Pokazują znaczenie nienaruszonej błony śluzowej jelita.
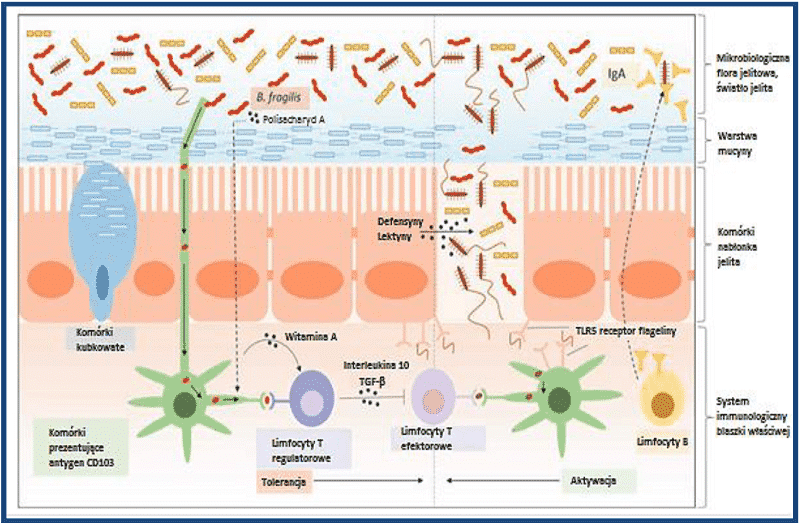
Błona śluzowa jelita: bariera i tolerancja
Jak, w skrajnym przypadku, ważna dla przeżycia jest nienaruszona błona śluzowa jelita, wyraźnie widać na przykładzie perforacji jelita ślepego. Liposacharydy bakteryjne w krwioobiegu mogą wówczas prowadzić do układowej aktywacji receptorów toll-like a w konsekwencji do sepsy, która nieleczona z reguły kończy się śmiercią. W tym wypadku to nawet nie sama infekcja bakteryjna jest zagrożeniem, a (systemowa) reakcja naszego układu odpornościowego.
Nie tylko komórki nabłonkowe jelita odgrywają ważną rolę przy tolerancji naszego systemu immunologicznego w stosunku do nieszkodliwych składników pokarmowych i symbiotycznych mikroorganizmów. Najnowsze badania procesu zachodzącego w błonie śluzowej jelita przyniosły zdumiewające odkrycia. Zarówno nieszkodliwe jak i chorobotwórcze drobnoustroje, podczas absorpcji w świetle przewodu pokarmowego, dzięki pewnym komórkom prezentującym antygen, posiadającym marker powierzchniowy CD103, pozostającym w kontakcie ze ścisłymi połączeniami komórek nabłonka jelitowego (tzw.tight junctions), migrują do węzłów chłonnych, gdzie są prezentowane limfocytom T. Przy tym komórki prezentujące antygen produkują pochodne witaminy A, aktywując w ten sposób limfocyty Th, tzw. limfocyty T regulatorowe, które z kolei hamują takie substancje, jak TGF-beta, interleukina 10 i inne komórki efektorowe (rys. 1). To wzajemne działanie pomiędzy komórkami prezentującymi antygen a regulacyjnymi limfocytami T odgrywa kluczową rolę przy zachowaniu zdolności systemu immunologicznego do tolerancji nieszkodliwych składników pokarmowych oraz symbiotycznych bakterii jelitowych.
Flora jelitowa i zapobieganie
IgE i IgA
Jaką rolę odgrywa wzajemne oddziaływanie symbiotycznej flory jelitowej i systemu immunologicznego przy zapobieganiu chorobom? Aby wyjaśnić, jak symbiotyczne bakterie jelita wpływają na nasz układ odpornościowy, naukowcy pracują z myszami, przy narodzinach których zastosowano cesarskie cięcie w sterylnych warunkach laboratoryjnych. Zwierzęta te nie miały więc żadnego kontaktu z bakteryjnymi mikroorganizmami i z perspektywy immunologicznej wykazały silną tendencję do reakcji autoimmunologicznych i alergii. Wiąże się to m.in. z tym, że w sterylnych warunkach dochodzi do wysokiej koncentracji swoistych przeciwciał IgE w surowicy, odpowiedzialnych za reakcje alergiczne. W przeciwieństwie do IgE, przeciwciała IgA nie powodują alergii. Odgrywają one główną rolę w procesie ochrony powierzchni błony śluzowej przed infekcjami oraz w utrzymaniu mikrobiologicznej homeostazy.
Natomiast po poddaniu tych myszy kontaktowi z symbiotycznymi bakteriami jelit, doszło do wzrostu ilości IgA w ich jelicie oraz spadku poziomu IgE (8).Specyficzne przeciwciała IgA, które są indukowane dzięki bakteriom symbiotycznym, mogą przy tym umożliwić ochronę przeciw patogennym bakteriom przez długi okres czasu.
Skład flory jelitowej zmienia się także w wyniku zmiany sposobu odżywiania. System immunologiczny dynamicznie reaguje na te zmiany i powstają nowe przeciwciała IgA (9). Wraz ze wzrastającym wiekiem zwiększa się różnorodność przeciwciał(10). Obok samych bakterii symbiotycznych, także ich produkty przemiany materii mają duże znaczenie przy powstrzymaniu rozwoju alergii pokarmowej i nieswoistych zapaleń jelit, takich jak choroba Leśniowskiego-Crohna czy wrzodziejące zapalenie jelita grubego (colitis ulcerosa). Przykładowo produkt przemiany materii bakterii szczepu Bacteroides fragilis-polisacharyd A, sprzyja rozwojowi wspomnianych wyżej, regulujących limfocytów T i w ten sposób wspomaga immunologiczną tolerancję (10).
Zdumiewające efekty dzięki przeszczepowi flory kałowej.
Również wadliwy przekaz sygnału w nabłonkach komórek jelitowych poprzez opisane wyżej receptory wrodzonego systemu immunologicznego może mieć ogromny wpływ na skład symbiotycznej flory jelitowej i tym samym dalekosiężne skutki dla naszego zdrowia. Myszy z genetycznie dezaktywowanymi określonymi receptorami wykazują znaczącą zmianę składu symbiotycznej flory jelitowej, co prowadzi u nich do przewlekłych chorób zapalnych jelit. Jeszcze bardziej zdumiewające jest spostrzeżenie, że tak zmieniona flora jelitowa po transplantacji do zdrowych myszy bez genetycznie dezaktywowanych receptorów, spowodowała te same dolegliwości (12). To pokazuje, jak ważny jest skład symbiotycznej mikroflory jelitowej przy zapobieganiu zapalnym chorobom jelit.
Skład mikrobiologicznej flory jelitowej jest istotny nie tylko przy rozwoju chorób jelit. Dysbioza może mieć również inne, daleko idące konsekwencje dla naszego zdrowia. Zmieniony skład mikroflory jelit może prowadzić myszy do nadwagi i otyłości, co można jednak cofnąć poprzez ponowny transfer bakterii gatunku Bacteroides tym myszom (13). Także flora jelitowa myszy ciężarnych znacząco różni się od tej u myszy, które nie są w ciąży. Flora jelitowa ciężarnych myszy przeniesiona do wysterylizowanych myszy, będzie również skutkowała otyłością(14). Prawdopodobnie główną rolę odgrywają tu hormony płciowe, które zmieniają się w czasie ciąży (15,16). Szczególnie istotny jest możliwy związek pomiędzy żeńskimi hormonami płciowymi a florą jelitową, ponieważ miliony kobiet przez większość swojego okresu rozrodczego przyjmuje estrogeny i progestageny jako środek antykoncepcyjny.
Najbardziej zadziwiające jest to, że istnieją nawet zależności pomiędzy florą jelitową a głęboko sięgającymi neuronalnymi zaburzeniami rozwoju, jak na przykład autyzm. W przeprowadzonych badaniach dzieci autystyczne wykazywały dysbiozę z niewielką różnorodnością bakterii flory jelitowej(17). W szczególności gatunki Prevotella i Coprococcus występowały w mniejszych ilościach niż u dzieci nieautystycznych.
To pokazuje, jak daleki związek może mieć flora jelit z naszym zdrowiem.
Spojrzenie na przyszłość
Dzięki odkryciu opisanych wyżej zależności, pojawiły się możliwości zamierzonej zmiany składu flory jelitowej, która uniemożliwiłaby dalszy rozwój dysbiozy i chorób z nią związanych, a nawet je leczyła. Mikroflora jelit nie jest stałą strukturą, lecz podlega dynamicznym zmianom. Na skład bakterii ma wpływ stosowanie antybiotyków, ale również nasz sposób odżywiania się (18,19). Ponadto oprócz diety, zmiany we florze jelitowej można uzyskać dzięki bezpośredniemu dostarczaniu bakterii (probiotyków) oraz przyjmowaniu prebiotyków, które są głównym źródłem energii dla określonych bakterii jelitowych. Także przyjmowanie pojedynczych składników mikrobiologicznych, jak np.flagelina, może mieć pozytywny wpływ na naszą florę jelitową oraz GALT (tkanka limfatyczna w przewodzie pokarmowym). Przyjęcie flageliny poprawiło odporność przeciwko patogennym zarazkom jelit Clostridium difficile u myszy leczonych antybiotykiem(20). Podczas długotrwałego przyjmowania antybiotyków skład flory jelitowej ulega zmianie, w wyniku której ilość C.difficile może się znacząco zwiększyć. Wytwarzana toksyna może w pewnych sytuacjach doprowadzić nawet do śmiertelnych biegunek. Poprzez przeszczepienie flory kałowej od zdrowych dawców do pacjentów z cyklicznymi infekcjami C.difficile przywrócono im różnorodność flory jelitowej, dzięki czemu pacjenci ci byli chronieni przed ponownymi infekcjami(21).
Wiele opisanych wyżej zależności można wykorzystać w praktyce dzięki analizie metagenomicznej kału (http://zdrowejelita.edu.pl/). Opiera się ona na jednoczesnym sekwencjonowaniu DNA mikrobiologicznych genów 16S-rybosomalnego RNA. W taki sposób skład mikroflory jelita, pobranej bezpośrednio z prób kału, może być znacznie dokładniej określony niż przy pomocy konwencjonalnych metod mikrobiologicznych. Dużym wyzwaniem przyszłości będzie analiza ogromnej ilości danych, które będą przy tym generowane. Za pomocą algorytmów i baz danych identyfikowane są już dzisiaj związki metaboliczne między różnymi symbiotycznymi mikroorganizmami, które mają ochronne działanie przeciw patogenom i chorobom(22). Z pewnością zostanie to wykorzystane w przyszłości w celach diagnostycznych i leczniczych.
BIBLIOGRAFIA:
1 Caballero S, Pamer EG. Microbiota-mediated inflammation and antimicrobial defence in the intestine. Annu Rev Immunol 2015; 33: 227–256
2 Shan M, Gentile M, Yeiser JR et al. Mucus enhances gut homeostasis and oral tolerance by delivering immunoregulatory signals. Science 2013; 342: 447–453
3 McDole JR, Wheeler LW, McDonald KG et al. Goblet cells deliver luminal antigen to CD103+ dendritic cells in the small intestine. Nature 2012; 483: 345–349
4 Gewirtz AT, Navas TA, Lyons S et al. Cutting edge: bacterial flagellin activates basolaterally expressed TLR5 to induce epithelial proinflammatory gene expression. J Immunol 2001; 167: 1882–1885
5 Farache J, Koren I, Milo I et al. Luminal bacteria recruit CD103+ dendritic cells into the intestinal epithelium to sample bacterial antigens for presentation. Immunity 2013; 38: 581–595
6 Coombes JL, Siddiqui KR, Arancibia-Carcamo CV et al. A functionally specialized population of mucosal CD103+ DCs induces Foxp3+ regulatory T cells via a TGF-beta and retinoic acid-dependent mechanism. J Exp Med 2007; 204: 1757–1764
7 Cahenzli J, Koller Y, Wyss M et al. Intestinal microbial diversity during early-life colonization shapes long-term IgE levels. Cell Host Microbe 2013; 14: 559–570
8 Lecuyer E, Rakotobe S, Lengline-Garnier H et al. Segmented filamentous bacterium uses secondary and tertiary lymphoid tissues to induce gut IgA and specific T helper 17 cell responses. Immunity 2014; 40: 608–620
9 Hapfelmeier S, Lawson MA, Slack E et al. Reversible microbial colonization of germ-free mice reveals the dynamics of IgA immune responses. Science 2010; 328: 1705–1709
10 Lindner C, Wahl B, Fohse L et al. Age, microbiota, and T cells shape diverse individual IgA repertoires in the intestine. J Exp Med 2012; 209: 365–377
11 Mazmanian SK, Liu CH, Tzianabos AO, Kasper DL. An immunomodulatory molecule of symbiotic bacteria directs maturation of the host immune system. Cell 2005; 122: 107–118
12 Elinav E, Strowig T, Kau AL et al. NLRP6 inflammasome regulates colonic microbial ecology and risk for colitis. Cell 2011; 145: 745–757
13 Ridaura VK, Faith JJ, Rey FE et al. Gut microbiota from twins discordant for obesity modulate metabolism in mice. Science 2013; 341: 1241214
14 Koren O, Goodrich JK, Cullender TC et al. Host remodeling of the gut microbiome and metabolic changes during pregnancy. Cell 2012; 150: 470–480
15 Menon R, Watson SE, Thomas LN et al. Diet complexity and estrogen receptor β status affect the composition of the murine intestinal microbiota. Appl Environ Microbiol 2013; 79: 5763–5773
16 Adlercreutz H, Pulkkinen MO, Hämäläinen EK, Korpela JT. Studies on the role of intestinal bacteria in metabolism of synthetic and natural steroid hormones. J Steroid Biochem 1984; 20: 217–229
17 Kang DW, Park JG, Ilhan ZE et al. Reduced incidence of Prevotella and other fermenters in intestinal microflora of autistic children. PLoS ONE 2013; 8: e68322
18 Antunes LC, Han J, Ferreira RB et al. Effect of antibiotic treatment on the intestinal metabolome. Antimicrob Agents Chemother 2011; 55: 1494–1503
19 David LA, Maurice CF, Carmody RN et al. Diet rapidly and reproducibly alters the human gut microbiome. Nature 2014; 505: 559–563
20 Jarchum I, Liu M, Lipuma L, Pamer EG. Toll-like receptor 5 stimulation protects mice from acute Clostridium difficile colitis. Infect Immun 2011; 79: 1498–1503
21 van Nood E, Vrieze A, Nieuwdorp M et al. Duodenal infusion of donor feces for recurrent Clostridium difficile. N Engl J Med 2013; 368: 407–415
22 Arumugam M, Raes J Pelletier E et al. Enterotypes of the human gut microbiome. Nature 2011; 473: 174–180