
Końcowe produkty glikacji (ang. AGE’s – Advanced glycationend-products) po raz pierwszy zidentyfikowano w poddanej obróbce termicznej żywności, jako produkty końcowe nieenzymatycznej reakcji, zwanej reakcją Maillarda, zachodzącą pomiędzy grupą aldehydową cukrów redukujących a grupą aminową białek [1].
Co to jest AGE’s?
AGE’s to grupa złożonych i heterogenicznych związków, które dzieli się na bezbarwne, nie fluoryzujące pre-melanoidyny, oraz barwne, fluoryzujące melanoidyny. Do tych pierwszych należą: glioksal, metyloglioksal, 3-deoksyglukozon oraz karboksymetylolizyna, a do drugiej grupy zaliczamy pentozydynę.

Oprócz AGE’s pochodzenia endogennego, wyróżnia się też końcowe produkty glikacji zewnątrzpochodne, występujące w żywności, a także w dymie tytoniowym. Są naturalnie obecne w nieprzetworzonych surowcach pochodzenia zwierzęcego, a obróbka termiczna inicjuje powstawanie nowych AGE’s w tych produktach. W szczególności grillowanie, pieczenie oraz smażenie są przyczyną powstawania końcowych produktów zaawansowanej glikacji. Do najlepiej przebadanych AGE’s należą stabilna i stosunkowo obojętna karboksymetylolizyna (CML) oraz wysoce reaktywne pochodne metylogliokosalu (MG). Oba te związki mogą pochodzić z glikoksydacji (połączenie procesów glikacji i oksydacji komórkowej) białek i lipidów [1].
Endogenne tworzenie AGE’s zachodzi we wszystkich tkankach i płynach ustrojowych w warunkach fizjologicznych poprzez reakcję glikacji. Endogenną glikację po raz pierwszy zaobserwowano na przykładzie hemoglobiny glikowanej (HbA1c), w którym N-końcowa reszta waliny reagowała z glukozą z wytworzeniem N-fruktozowaliny. Spośród wszystkich węglowodanów glukoza charakteryzuje się najniższym potencjałem glikacji, podczas gdy fruktoza, wytwarza AGE’s z większą intensywnością [2].
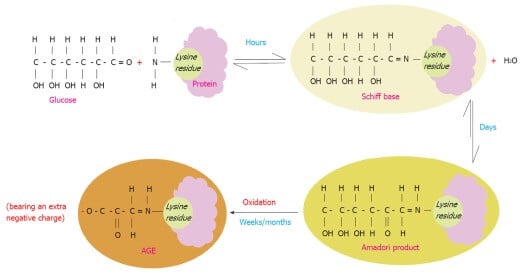
Glikacja, a właściwie nieenzymatyczna N-glikozylacją białek
Proces, w którym produktami reakcji są AGE’s nazywa się potocznie glikacją, a dokładniej nieenzymatyczną N-glikozylacją białek. Obejmuje on między innymi wszystkie proteiny o wysokiej zawartości wolnych grup aminowych, czyli tych, w których strukturze znajduje się lizyna. Kontynuując badania nad reakcją Maillarda, wykazano, że reakcja ta zachodzi również in vivo, a termin „glikacja” wprowadzono jako synonim „nieenzymatycznej glikozylacji”, aby odróżnić ją od glikozylacji enzymatycznej białek [3].
Zasadniczo istnieją trzy etapy nieenzymatycznego procesu glikacji in vivo:
- Glikacja jest inicjowana przez kowalencyjne przyłączenie cukrów redukujących do grup aminowych białek, lipidów lub kwasów nukleinowych w celu wytworzenia odwracalnej i niestabilnej zasady Schiffa.
- Następnie wytworzona zasada Schiffa może ulec zamianie w bardziej stabilne produkty o nazwie Amadori.
- Produkty Amadori ulegają odwodnieniu i przegrupowaniu z wytworzeniem AGE’s [1][3].
W reakcji Maillarda ważne jest tworzenie reaktywnych produktów pośrednich podczas przegrupowania Amadori. Reaktywne związki karbonylowe wytwarzane przez samoutlenianie węglowodanów, peroksydację lipidów i uszkodzenie spowodowane promieniowaniem UV, mogą również przyczyniać się do powstawania AGE’s. Akumulacja reaktywnych prekursorów dikarbonylowych lub produktów glikoksydacji nazywa się stresem karbonylowym, który obserwuje się zarówno w cukrzycy, jak i mocznicy i jest on związany z przyspieszonym uszkodzeniem naczyń obserwowanym w obu tych stanach patologicznych [1].
AGE’s w żywności czyli DAGE’s
Najwyższe poziomy DAGE’s w produktach odzwierzęcych występują w wołowinie i serach, następnie w drobiu, wieprzowinie, rybach i jajach. Jagnięcina plasuje się stosunkowo nisko jeśli chodzi o zawartość DAGE’s w porównaniu do innych mięs.
Wysokotłuszczowe i dojrzewające sery, jak np. parmezan, zawierają więcej DAGE’s niż np. mozzarella czy twaróg o obniżonej zawartości tłuszczu. Produkty wysokotłuszczowe do smarowania, w tym masło, sery śmietankowe, margaryna i majonez, również zawierają znaczną ilość DAGE’s. Może to wynikać z różnych procedur ekstrakcji oraz oczyszczania z wykorzystaniem ciepła.

Szybkość tworzenia się DAGE’s w żywności zależy od takich czynników, jak skład, pH, wilgotność, a także dostępność przeciwutleniaczy, ponieważ mają one decydujący wpływ na szybkość reakcji Maillarda.
Szybkość reakcji Maillarda obniża się przy niskim pH, ale wzrasta wprost proporcjonalnie, aż do osiągnięcia maksimum przy około pH=10. Przy wyższych poziomach wilgoci obserwuje się spadek szybkości reakcji z powodu rozcieńczenia reagentów w fazie wodnej. Powstawanie DAGE’s jest mniejsze podczas podgrzewania w piekarniku w wysokiej wilgotności, krótszym czasie gotowania lub przez zastosowanie kwaśnych składników, jak sok z cytryny lub ocet [1].
Mechanizm patologicznego działania AGE’s
Patologiczne działanie AGE’s jest związane z ich zdolnością do promowania stresu oksydacyjnego i zapalenia, poprzez wiązanie się z receptorami na powierzchni komórki zmieniając ich strukturę i funkcję. Swoistym receptorem dla produktów końcowych zaawansowanej glikacji jest RAGE, działa on jak „zmiatacz” i pośredniczy w sygnalizacji wewnątrzkomórkowej. Badania in vitro wykazały, że wiązanie AGE-RAGE na makrofagach i mikrogleju prowadzi do promowania stresu oksydacyjnego i aktywacji czynnika transkrypcyjnego NF-ҡB, a także szlaków sygnałowych, m.in. MAPK, JNK i p21RAS. NF-ҡB jest wrażliwym na wolne rodniki czynnikiem transkrypcyjnym, który moduluje transkrypcję genu dla endoteliny-1, czynnika tkankowego i trombomoduliny. Nasila się również produkcja cytokin prozapalnych i czynników wzrostu [2][4].
Chociaż wcześniej uznawano, że wzrost poziomu glukozy odgrywa podstawową rolę w reakcji glikacji, to cukier ten jest najmniej reaktywny w układach biologicznych. W rzeczywistości, tworzenie AGE’s zależy od różnych metabolitów. 1,5-anhydro-D-fruktoza (1,5-AF) jest półproduktem metabolizmu glikogenu. Uważa się, że 1,5-AF jest ważniejsza w tworzeniu AGE’s niż glukoza i fruktoza. Chociaż postulowano tworzenie się AF-AGE in vivo, nie uzyskano dowodów potwierdzających [5].

Skutki nadmiernej akumulacji AGE’s, czym grożą?
Tworzenie i akumulacja AGE’s jest charakterystyczną cechą tkanek osób starszych, szczególnie wśród pacjentów z cukrzycą. Modyfikacje kolagenu I klasy oraz proteoglikanu w procesie glikacji są przyczyną sztywności ścian naczyń oraz wzrostu w nich ciśnienia krwi, co w konsekwencji prowadzi do rozwoju chorób sercowo-naczyniowych. Podwyższone poziomy AGE’s w surowicy pacjentów z cukrzycą przyspieszają zarówno rozwój, jak i postęp niewydolności serca. Działają pośrednio poprzez wiązanie się z receptorem RAGE oraz bezpośrednio, negatywnie oddziałując na mięsień sercowy. Nieenzymatyczna glikacja białek ma również związek z powstawaniem powikłań o charakterze mikroangiopatii w cukrzycy [2].
Wykazano, że akumulacja końcowych produktów zaawansowanej glikacji odgrywa rolę w rozwoju i postępie chorób związanych z wiekiem, takich jak choroba zwyrodnieniowa stawów, poprzez promowanie uwalniania cytokin i chemokin, wytwarzanie reaktywnych form tlenu oraz aktywację prozapalnej ścieżki sygnalizacyjnej NF-κB [6].
Podsumowanie
Negatywny wpływ AGE’s na zdrowie nie oznacza, że musisz odstawić grillowanie czy smażenie raz na zawsze do lamusa. Należy nauczyć się segregować informacje, tak aby te mniej ważne nie przysłoniły tych najważniejszych, racjonalnych zasad zdrowego żywienia. Podobnie jak w przypadku innych „problemów dietetycznych”, kluczem jest umiar.

Literatura
- C. Sharma, A. Kaur, S. S. Thind, B. Singh, and S. Raina, “Advanced glycation End-products (AGEs): an emerging concern for processed food industries.,” J. Food Sci. Technol., vol. 52, no. 12, pp. 7561–76, Dec. 2015.
- Z. Hegab, S. Gibbons, L. Neyses, and M. A. Mamas, “Role of advanced glycation end products in cardiovascular disease.,” World J. Cardiol., vol. 4, no. 4, pp. 90–102, Apr. 2012.
- P. Gkogkolou and M. Böhm, “Advanced glycation end products: Key players in skin aging?,” Dermatoendocrinol., vol. 4, no. 3, pp. 259–70, Jul. 2012.
- P. B. L. Pun and M. P. Murphy, “Pathological Significance of Mitochondrial Glycation,” Int. J. Cell Biol., vol. 2012, pp. 1–13, Jun. 2012.
- A. Sakasai-Sakai, T. Takata, H. Suzuki, I. Maruyama, Y. Motomiya, and M. Takeuchi, “Immunological evidence for in vivo production of novel advanced glycation end-products from 1,5-anhydro-D-fructose, a glycogen metabolite.,” Sci. Rep., vol. 9, no. 1, p. 10194, Jul. 2019.
- S. Zhu et al., “Sitagliptin ameliorates advanced glycation end-product (AGE)-induced degradation of extracellular matrix in human primary chondrocytes.,” Am. J. Transl. Res., vol. 11, no. 5, pp. 2775–2783, 2019.







