
Rola żelaza w organizmie jest niezwykle istotna: stanowi ono składnik grup prostetycznych wielu białek (hemoglobina, mioglobina, układ cytochromów, katalaza, peroksydaza), determinuje ich aktywność i funkcje. Jest niezbędne do prawidłowego przebiegu głównych procesów biologicznych organizmu, takich jak oddychanie komórkowe, synteza i naprawa DNA czy transport tlenu przez hemoglobinę . Pozostałą cześć żelaza stanowi pula zapasowa, większa u mężczyzn niż u kobiet, znajdująca się w połączeniach z ferrytyną czy jako hemosyderyna .
Ze względu na małe dzienne zapotrzebowanie oraz niską zawartość w ustroju żelazo jest zaliczane do mikroelementów: w organizmie dorosłego człowieka znajduje się od 3 do 5 g żelaza – średnio na 1 kg m.c. dorosłego człowieka przypada do 40 mg żelaza u kobiet oraz do 50 mg żelaza u mężczyzn. W wątrobie, szpiku kostnym, śledzionie oraz mięśniach magazynowane jest żelazo w ilości około 5 mg/kg m.c. u kobiet, u mężczyzn – 10-12 mg/kg m.c. Pozostała część żelaza (ok. 20-30 mg/dobę), znajdującego się w nieustannym obiegu, jest kumulowana i uwalniana przez makrofagi fagocytujące krwinki czerwone .
Organizm człowieka, podobnie jak innych ssaków, charakteryzuje się dość sprawnym mechanizmem pozwalającym na wchłanianie żelaza, ale przy braku analogicznego mechanizmu pozwalającego na sprawną eliminację jego nadmiaru (wyjątek stanowią krwawienia menstruacyjne u kobiet, wraz z którym z organizmu usuwane jest żelazo). U osób dorosłych mechanizm gospodarki żelazem odbywa się niemalże w cyklu zamkniętym, ale bardzo dynamicznym.

Proces wchłaniania żelaza
Wchłanianie żelaza w przewodzie pokarmowym odbywa się w górnym odcinku jelita cienkiego. Proces ten zachodzi w środowisku kwaśnym, przy udziale ferroreduktazy. Za absorpcję żelaza ze światła jelita do wnętrza enterocytów odpowiadają dwa rodzaje białek: dwunastniczy cytochrom b oraz transporter metali dwuwartościowych DMT1 (divalent metal transporter 1). W komórce część żelaza wykorzystywana jest dla jej potrzeb, reszta, dzięki białku błonowemu – ferroportynie, z komórek jelita cienkiego trafia do układu krążenia, gdzie ulega ponownemu utlenieniu i po połączeniu z transferryną dociera do odpowiednich tkanek i narządów. W szpiku kostnym żelazo jest wykorzystywane do tworzenia krwinek czerwonych, a jego niewykorzystana część może być magazynowana w postaci wspomnianej ferrytyny lub hemosyderyny. Efektywność tego procesu zależy w dużym stopniu od formy dostarczanego składnika: wchłanianie żelaza w postaci hemowej osiąga ok. 20%, w postaci niehemowej – 1-5%, przy czym ten rodzaj żelaza dominuje w diecie (ok. 90%) .
Czynnikiem determinującym proces wchłaniania i dystrybucji żelaza z przewodu pokarmowego jest również jego wartościowość. Mikropierwiastek ten może dostawać się do organizmu i występować w nim w dwóch postaciach: utlenionej Fe2+ oraz zredukowanej Fe3+. Przed rozpoczęciem procesu wchłaniania do wnętrza enterocytów żelazo trójwartościowe jest redukowane poprzez enzym – reduktazę, do postaci dwuwartościowej (postać łatwoprzyswajalna).
Cecha żelaza jako metalu przejściowego (zmiana wartościowości) jest przyczyną pewnych zmian w ustroju: powstawaniu rodnika hydroksylowego (OH) w wyniku reakcji jonu żelazawego (Fe2+) oraz nadtlenku wodoru. Rodnik hydroksylowy jest niezwykle reaktywną i silnie utleniającą cząstką, przez co może przyczyniać się do peroksydacji lipidów, jak i uszkodzenia DNA. Według naukowców zbyt duża pula wolnego żelaza w organizmie oraz wynikająca z tego kumulacja reaktywnych form tlenu ROS (reactive oxigen species), zwiększa ryzyko wystąpienia wielu schorzeń, m.in. kardiomiopatii, miażdżycy, zakażeń bakteryjnych, nowotworzenia oraz chorób wątroby.
Regulacja gospodarki żelazem – rola hepcydyny
Celem utrzymania homeostazy żelaza jest zatem umożliwienie jego wykorzystania przez organizm, ale również ograniczenie toksyczności. Podstawowym mechanizmem obrony organizmu przed toksycznością żelaza jest system białek i transporterów. Regulacja wchłaniania żelaza odbywa się zarówno na poziomie ekspresji białek uczestniczących w jego absorpcji do enterocytu oraz dystrybucji w układzie krwionośnym, jak i na poziomie hormonalnym. Jednym ze sposobów regulacji poziomu żelaza jest hormon znany jako hepcydyna.
Najważniejszym organem odpowiedzialnym za utrzymanie równowagi gospodarki żelazowej w ustroju człowieka, jak i miejscem przechowywania jego nadmiaru, jest wątroba. To w jej komórkach, hepatocytach, syntezowana jest hepcydyna, chociaż w nieznacznych ilościach stwierdza się jej obecność także w sercu i mózgu.
Wyizolowany po raz pierwszy z krwi i moczu hormon pod postacią hepcydyny uznawany jest za podstawowy regulator poziomu żelaza, a także mediator wrodzonej odporności.
Hepcydyna jest zaliczana do hormonów peptydowych o działaniu przeciwbakteryjnym, odgrywającą główną rolę w procesie wchłaniania i rozprowadzania żelaza w organizmie. Spośród trzech izoform obecnych w ustroju tylko izooforma 25-aminokwasowa (hepcydyna-25) ma udział w regulacji metabolizmu żelaza.. Oznaczenie stężenia hepcydyny w surowicy lub moczu wykonuje się przy pomocy badań immunochemicznych, za pomocą automatycznych analizatorów.
Hepcydyna jest także silnym mediatorem niedokrwistości, która towarzyszy stanom zapalnym. W przypadku hemochromatozy wrodzonej czy niedokrwistości z powodu braku żelaza stężenie hepcydyny-25 jest zmniejszone, zwiększone natomiast w przypadkach zapaleń, zakażeń, przewlekłej choroby nerek i niedokrwistości chorób przewlekłych.
Mechanizm działania hepcydyny
Zbyt wysoka podaż żelaza egzogennego jest przyczyną wzmożonej produkcji hepcydyny w wątrobie, wzrostu jej stężenia we krwi, a w efekcie ograniczenia wchłaniania żelaza z przewodu pokarmowego. Również w stanie infekcji, dochodzi do wzrostu wytwarzania białek wiążących metal, wydzielania laktoferyny z ziarnistości granulocytów obojętnochłonnych, ograniczenia wchłaniania żelaza ze stosowanej diety i/lub zmniejszonego odzysku pierwiastka ze sfagocytowanych erytrocytów. Dwa ostatnie mechanizmy w dużej mierze zależą od hepcydyny.
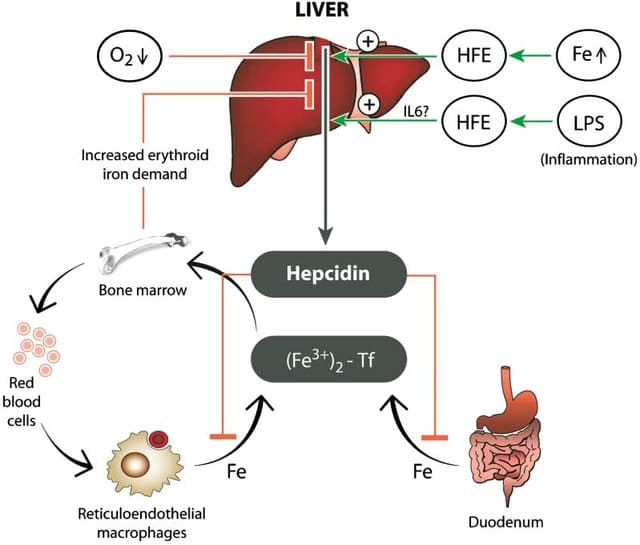
Hepcydyna oddziałuje na komórki poprzez wiązanie z ferroportyną, występującą głownie w komórkach ściśle związanych z metabolizmem żelaza: na absorpcyjnej powierzchni enterocytów, w makrofagach, hepatocytach, komórkach łożyska i komórkach prekursorowych erytropoezy. Poprzez połączenie z ferroportyną hepcydyna powoduje jej fosforylację i internalizację (usunięcie z błony komórkowej). Po usunięciu ferroportyny z błony komórkowej do pęcherzyków endosomalnych, dochodzi do jej degradacji. Inaktywacja ferroportyny na powierzchni enterocytów doprowadza do zatrzymywania żelaza w enterocytach i jego usunięcia wraz ze złuszczającym się nabłonkiem jelitowym. Proces ten dodatkowo hamuje recyrkulację żelaza z komórek układu siateczkowo-śródbłonkowego. Należy jednak pamiętać, że aktywność ferroportyny nie zależy jedynie od aktywności hepcydyny, ale również od zapotrzebowania na żelazo komórek, które wykazują jej ekspresję.
Na ekspresję hepcydyny wpływają przede wszystkim wątrobowe zapasy żelaza, aktywność erytropoetyczna szpiku kostnego, stan zapalny i hipoksja oraz stężenie holotransferryny. Synteza hepcydyny jest hamowana natomiast przez wzmożoną aktywność erytropoetyczną szpiku.
W przypadku niedoboru hepcydyny sytuacja jest odwrotna: synteza ferroportyny przeważa nad jej degradacją. Błony komórkowe obfitują w ferroportynę, zwiększa się transport żelaza przez powierzchnię enterocytów do krążenia oraz wypływ żelaza z komórek żernych do płynu zewnątrzkomórkowego.
Podsumowanie
Hepcydyna (określana mianem „ferrostatu”), odgrywa główną rolę w metabolizmie żelaza, pomocną także jako wskaźnik odpowiedzi na doustną suplementację żelazem. Zastosowanie terapii hamującej jej ekspresję może być pomocne w leczeniu niedokrwistości chorób przewlekłych w przebiegu nieswoistych zapaleń jelit oraz redukcji procesu zapalnego.
Obecnie prowadzi się badania w celu ujednolicenia metody pomiaru hepcydyny oraz określenia zakresu wartości referencyjnych u pacjentów z chorobą Leśniowskiego-Crohna i wrzodziejącym zapaleniem jelita grubego w zależności od aktywności i zaawansowania choroby, jak również nad praktycznym zastosowaniem hepcydyny w diagnostyce i leczeniu niedokrwistości.
Literatura:
- Gajewski P., Szczeklik A., Interna Szczeklika 2017, Medycyna Praltyczna, Kraków 2017, str. 1683
- Ganz T., Hepcidin, A key regulator og iron metabolism and mediator of anemia of inflammation. Blood 2003,102 (3), 783-788.
- Ganz T., Iron homeostasis: fitting the puzzle pieces together.Cell Metab., 2008; 7: 288-290
- Hentze, M. W., Muckenthaler, M. U., & Andrews, N. C. (2004). Balancing acts: molecular control of mammalian iron metabolism. cell, 117(3), 285-297.
- Korzeniowska K., Cieślewicz A., Jabłecka A., Zaburzenia gospodarki żelaza, Farmacja Współczesna 2012, 5, 83
- Kubiak T., Rola transferyny w przeciwdziałaniu stresowi oksydacyjnemu indukowanemu wolnym żelazem w organizmie i jej potencjalne związki z rozwojem nowotworów. Kosmos. Problemy Nauk Biologicznych. 2013, 62, 501–505
- Lipiński P., Starzyński R., Styś A., Heme metabolism as an integral part of iron homeostasis, Postępy Higieny i Medycyny Doświadczalnej 2014, 68, 557–570
- Lloyd R.V., Hanna P.M., Mason R.P., The origin of the hydroxyl radical oxygen in the Fenton reaction. Free Radic. Biol. Med. 1997, 22, 885–888
- Nicolas G., Chauvet C., Viatte L., Danan J.L., Bigard X., Devaux I., Beaumont C., Kahn A., Vaulont S., The gene encoding the iron regulatory peptide hepcidin is regulated by anemia, hypoxia, and inflammation. J. Clin. Invest. 2002, 110, 1037-1044
- Puntarulo S., Iron, oxidative stress and human health. Mol. Aspects Med. 2005, 26, 299–312
- Sokołowska E, Klimek J., Hepcydyna — hormon uczestniczący w regulacji metabolizmu żelaza w organizmie. Post Biol Komórki 2007, 34, 15–30.
- Wierzbicka D, Gromadzka G., Ceruloplasmin, hephaestin and zyklopen: the three multicopper oxidases important for hu¬man iron metabolism, Postępy Higieny i Medycyny Doświadczalnej 2014, 68, 912–924
- Włodarek D., Lange E., Kozłowska L., Głąbska D., Dietoterapia, PZWL, Warszawa 2015, str. 150
- Zhang D.L., Hughes R.M., Ollivierre-Wilson H., Ghosh M.C., Rouault T.A.: A ferroportin transcript that lacks an iron-responsive elementenables duodenal and erythroid precursor cells to evade translationalrepression. Cell Metab., 2009, 9, 461-473







