
Oddziaływanie żywności na wchłanianie leków jest szczególne ważne w kwestii leków o wąskim indeksie terapeutycznym. W ich przypadku zmiany skuteczności leku można zauważyć już przy małych zmianach dawki [Virilli i in., 2019]. Pokarm może zmniejszyć lub zwiększyć biodostępność danego leku. W takim przypadku warto szerzyć wiedzę na ten temat. Nie tylko wśród lekarzy i specjalistów z zakresu dietetyki, lecz również pacjentów. Jednym z takich leków jest omówiona tutaj l-tyroksyna.
Czym jest L-tyroksyna?
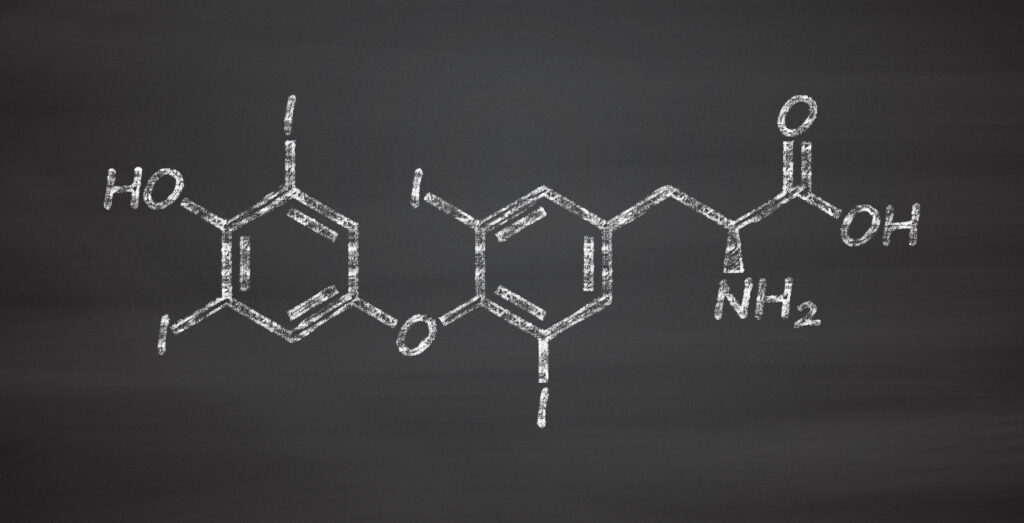
L-tyroksyna (Levothyroxinum natricum) to syntetyczny enancjomer o konfiguracji L naturalnego hormonu tarczycy — tyroksyny [Kostkowski i Herman, 2010]. Inaczej nazywana jest lewotyroksyną. Biologicznie i fizjologicznie lewotyroksyna jest nie do odróżnienia od naturalnej tyroksyny.
Stosowana jest najczęściej w leczeniu niedoczynności tarczycy jako lek tzw. „pierwszego rzutu” w terapii zastępczej. Celem leczenia L-tyroksyną jest normalizacja poziomu hormonu tyreotropowego (TSH) w surowicy. Dostosowanie odpowiedniej dawki leku przez lekarzy odbywa się najczęściej metodą prób i błędów [Öztas i in., 2018]. L-tyroksyna jest lekiem o wąskim indeksie terapeutycznym [Olejniczak-Rabinek, 2016].
Klasyfikacja BDDCS (Biopharmaceutical Drug Disposition Classification System) dzieli leki na 4 podstawowe klasy. Dzieli się je względem ich rozpuszczalności, przepuszczalności i metabolizmu. Lewotyroksyna została zakwalifikowana do klasy III. Należą do niej leki o wysokiej rozpuszczalności, ale małej przepuszczalności [Skelin i in., 2017].
Sól sodowa L-tyroksyny jest lekiem stosowanym w celu uzyskania równowagi hormonalnej w organizmie człowieka. Jest podawana pacjentom leczonym na niedoczynność tarczycy (zarówno pierwotną, jak i wtórną), wole, ostre zapalenie tarczycy
Wykorzystywana jest również po chirurgicznym usunięciu tarczycy. Znajduje też zastosowanie u osób z nowotworem tarczycy po radioterapii [Olejniczak-Rabinek, 2016]. Terapia lewotyroksyną jest skuteczna u osób z uporczywym rakiem przerzutowym. Stosowana jest też u pacjentów z grupy wysokiego ryzyka („wolnych od choroby”). Stanowi wtedy czynnik zmniejszający wystąpienie nawrotów [Irokoze i in., 2018]. Zapobiega wznowom wola tarczycy u pacjentów z prawidłową czynnością tarczycy po leczeniu operacyjnym. Pomocniczo stosuje się ją także w leczeniu nadczynności tarczycy w terapii skojarzeniowej z tyreostatykami po uzyskaniu stanu eutyreozy.
Wchłanianie L-tyroksyny w przewodzie pokarmowym
Wchłanianie leku rozpoczyna się po upływie ok. 60-90 min od spożycia. Sól sodowa L-tyroksyny w formie tabletki po połknięciu ulega rozpuszczeniu w sokach żołądkowych. Z tego powodu na absorpcję L-tyroksyny w przewodzie pokarmowym duży wpływ ma pH żołądka.
Fizjologiczny poziom pH zapewnia optymalne warunki do prawidłowego rozpoczęcia wchłaniania. Wzrost pH (zobojętnienie kwasów żołądkowych) zmniejsza biodostępność leku [Ianiro i in., 2014]. Rozpuszczalność lewotyroksyny spada wraz ze wzrostem pH powyżej 1-2. Osiąga najniższe wartości dla pH 3-7. Następnie wzrasta ponownie przy pH >7 [Virili i in., 2019]. Sól sodowa L-T4 w żołądku może pozostać częściowo niezdysocjowana. Zdarzenie to może osłabić wydolność kolejnego etapu wchłaniania w obrębie jelit.
W samym żołądku lewotyroksyna jest wchłaniana w niewielkim stopniu. Głównym miejscem absorpcji jest jelito cienkie. W dwunastnicy wchłaniane jest około 21% L-tyroksyny. 45% wchłaniane jest w jelicie czczym, a około 35% w jelicie krętym [Biondi i Wartofsky, 2014].
Czynniki wpływające na wchłanianie leku
Na wchłanianie L-tyroksyny w organizmie człowieka może mieć wpływ wiele czynników.
Najbardziej istotne z nich to:
- Czynniki fizjologiczne,
- Patofizjologiczne,
- Pora przyjmowania leku,
- Postać leku,
- Nawyki żywieniowe,
- Przestrzeganie zaleceń lekarskich [Olejniczak-Rabinek, 2016].
Część z nich jest zależna od pacjenta. Na część, jak np. wiek, płeć, czy choroby współistniejące pacjent nie ma wpływu [Öztas i in., 2018]. Tak wiele parametrów mających wpływ na poziom L-tyroksyny prowadzi do problemów w ustaleniu indywidualnej dawki leku. W konsekwencji może powodować niezadowalające efekty leczenia lub ich brak.
Szacuje się, że u ok. 40% pacjentów przyjmujących lewotyroksynę nie udaje się uzyskać odpowiedniego stężenia TSH. U pacjentów w podeszłym wieku liczba ta zwiększa się do 57% [Okosieme i in., 2011].
Forma podawanego leku
Zwykłe preparaty L-tyroksyny są dostępne w postaci tabletek. Istnieją także nowe formy w miękkich kapsułkach żelowych lub w postaci płynnej. Również one znalazły zastosowanie kliniczne [Vita i in., 2014].
Wiele badań porównało skuteczność tych preparatów wśród pacjentów – zarówno z zespołem złego wchłaniania LT-4, jak i bez. U pacjentów z zespołem złego wchłaniania L-tyroksyny płynna postać leku stanowi lepszą alternatywną terapię, gdy docelowo nie osiągnięto unormowania poziomu TSH w surowicy tabletkami.
Badania dowodzą, że płynna lewotyroksyna ma lepszy efekt terapeutyczny w przypadku:
- pacjentów poddawanych operacjom bariatrycznym [Pirolai in., 2013; Fallahi i in., 2017],
- podczas przyjmowania inhibitorów pompy protonowej (IPP) lub jednoczesnego przyjmowania innych leków [Cappelli i in., 2016; Vita i in., 2014],
- z infekcją Helicobacter pylori [Ribichini i in., 2017],
- po tyreoidektomii na skutek raka tarczycy [Cappelli i in., 2017],
- u osób przyjmujących lek jednocześnie ze śniadaniem [Morelli i in., 2016; Formenti i in., 2016].
Miękkie żelowe kapsułki lewotyroksyny dzięki swojej strukturze (substancja aktywna rozpuszczona w glicerynie zamknięta w żelatynowej kapsułce) zapewnia ochronę przed zmianami pH żołądka i jest w stanie zapobiec wiązaniu innych substancji w świetle żołądka. Ponadto kapsułki mają bardziej stały profil rozpuszczania i zwiększoną szybkość wchłaniania w porównaniu do tabletek.
Pora podawania leku
Stopień wypełnienia żołądka, a także czas, który minął między przyjęciem leku, a spożyciem posiłku w sposób znaczący wpływa na wchłanianie lewotyroksyny. Zaleca się podawanie leku na czczo co najmniej 30-60 minut przed śniadaniem lub przed snem 4 godziny po ostatnim posiłku [Garber i in., 2012]. Istnieje wiele badań zajmujących się analizą zależności pomiędzy czasem przyjęcia leku a stężeniem TSH we krwi. Jeśli lek jest przyjmowany po posiłku, to jego absorpcja jest istotnie obniżona.
Bach-Hyungh i inni (2009) w swoich badaniach podawali pacjentom lek o różnych porach. Sprawdzali działanie na czczo, godzinę przed posiłkiem, 20 min po posiłku oraz przed snem. Następnie obserwowali absorpcję lewotyroksyny i poziom TSH. Najlepsze wyniki uzyskano, gdy pacjenci przyjmowali lek godzinę przed posiłkiem (TSH=1,06mIU/l). Zadowalające efekty wchłaniania leku uzyskano również przy przyjmowaniu leku przed snem. Może mieć to związek ze zmniejszoną czynnością jelit w ciągu nocy, w związku z czym lewotyroksyna pozostawała dłużej w jelitach, gdzie ulegała wchłanianiu. Daje to możliwość uzyskania dobrych efektów terapeutycznych u pacjentów z chorobami współistniejącymi, którzy zażywają rano leki mogące obniżać biodostępność L-tyroksyny.
Pang i inni (2019) w swojej metaanalizie dokonali przeglądu i analizy statystycznej dostępnych badań na temat czasu spożycia L-tyroksyny względem posiłków. Zaobserwowali, że nie występują istotne różnice w poziomach TSH i fT3, gdy porównywano podawanie L-T4 przed snem i przed śniadaniem. Natomiast wyższy poziom fT4 zauważono u osób przyjmujących lek przed snem. Mimo to badacze przychylają się nad spożywaniem lewotyroksyny przed snem, uzasadniając to kilkoma faktami naukowymi. 60-82% podanej dawki L-tyroksyny jest wchłanianie w ciągu 3 godzin od przyjęcia leku. Sugeruje to, że godzinna przerwa przed śniadaniem może nie być wystarczająca. Dodatkowo samo śniadanie może zawierać produkty obniżające wchłanianie leku. Mimo wszystko nawet producenci leku L-tyroksyny zalecają przyjmowanie go na czczo co najmniej pół godziny przed śniadaniem.
Choroby dotyczące przewodu pokarmowego
Z dostępnych doniesień naukowych wynika, że zaburzenia przewodu pokarmowego znacząco wpływają na biodostępność lewotyroksyny w organizmie. Do tych dolegliwości zalicza się:
- celiakię,
- nietolerancję laktozy,
- stany zapalne żołądka,
- zakażenie Helicobacter pylori,
- zakażenie Giardia lamblia,
- zaburzenia mikroflory jelitowej.
Poza tym znaczny wpływ na wchłanianie L-tyroksyny mają zabiegi chirurgiczne w obrębie żołądka i jelit, w tym operacje bariatryczne.
Interakcje L-tyroksyny z żywnością
Błonnik
Już 1957 roku Van Middlesworth donosił, że pokarm bogaty w celulozę lub otręby powoduje zwiększoną utratę lewotyroksyny w kale u szczurów. Następnie w 1996 roku Liel i inni wykazali nieswoistą, zależną od dawki adsorpcję hormonu przez otręby pszenne w warunkach in vitro. Wyjaśniało to zwiększoną potrzebę przyjmowania większych dawek L-tyroksyny u pacjentów z niedoczynnością tarczycy, którzy zwiększyli spożycie błonnika.
Kawa
Badania wykazują, że kawa wpływa negatywnie na wchłanianie L-tyroksyny. Benvenga i in. (2008) zbadali zmiany poziomu TSH po przyjęciu lewotyroksyny z wodą, kawą oraz w sytuacji gdzie lek popito wodą, a po 60 minutach spożyto kawę.
W wyniku przeprowadzonego eksperymentu badacze stwierdzili, że negatywny wpływ kawy espresso był zmienny i obecny tylko w przypadku przyjęcia L-T4 jednocześnie z kawą. Spożycie kawy po 60 minutach od lewotyroksyny nie miało wpływu na poziom TSH.
W 2013 roku przeprowadzono badanie mające na celu ocenę czy forma leku (tabletki i kapsułki) podawanych pacjentom spożywającym kawę po przyjęciu L-T4, ma znaczenie i wpływ na poziom TSH w surowicy krwi. Okazuje się, że u osób, które nie potrafią odmówić sobie kawy, lepsze wyniki terapii osiąga się przy podawaniu im kapsułek, zamiast standardowych tabletek. Badacze udowodnili w swoim badaniu również, że godzina to optymalny czas, jaki musi upłynąć od przyjęcia L-tyroksyny, aby nie wystąpiły negatywne skutki interakcji z kawą [Vita i in., 2013].
Grejpfrut
Sok grejpfrutowy jest produktem najbardziej zbadanym i wywołuje klinicznie istotne interakcje. Zidentyfikowano ponad 85 interakcji pomiędzy lekami a flawonoidami soku grejpfrutowego.
Spożycie zaledwie jednego grejpfruta lub jednej szklanki soku wywołuje inaktywację enzymu CYP 3A4 (izoenzymu cytochromu P450 3A4) w jelitach. Przeprowadzone badania wykazują, że spożywanie przez pacjentów soku grejpfrutowego obniża ilość wchłoniętej lewotyroksyny.
U pacjentów, którym podawano sok grejpfrutowy, wchłonięciu uległo 76% dziennej dawki leku. W próbie kontrolnej, w której zastosowano wodę zamiast soku wchłonęło się 85% dawki. Czas osiągnięcia maksymalnego stężenia (Tmax) L-tyroksyny również się wydłużył z 1,5 godziny w próbie kontrolnej do 3 godzin dla soku grejpfrutowego. Autorzy badania twierdzą, że sok grejpfrutowy ma niewielki wpływ na zaburzenie wchłaniania L-T4 w jelitach. Nie można jednak wykluczyć, że długotrwałe stosowanie soku może wpływać na krążenie jelitowo-wątrobowe lewotyroksyny [Lilja i in., 2005].
Papaja
Owoce papai zawierają proteolityczne enzymy, w tym papainę, która zmniejsza wydzielanie kwasu żołądkowego indukowane histaminą. Już 2 godziny po spożyciu owocu obserwuje się hamowanie wydzielania kwasu. Utrzymuje się ono nawet do 48 godzin. Badacze sugerują, że włókna papai mogą również wiązać L-tyroksynę w jelicie [Deiana i in., 2012]. Ponadto niektóre składniki papai mogą hamować jelitowe enzymy bakteryjne, które dekoniungują kompleksy glukuronidu. Może to przerwać krążenie jelitowo-wątrobowe hormonów tarczycy. W konsekwencji może to powodować utratę 10-20% hormonów.
Badanie opublikowane w 2012 roku dowodzi, że po 14 dniach codziennego spożywania 5-6 sztuk dojrzałych owoców papai poziom TSH u pacjenta wzrósł z wyjściowej wartości 0,8 mIU/l do 15,0 mIU/l, co wiązało się z redukcją fT4 z 1,31 do 0,6 ng/dl i fT3 z 2,9 do 2,1 pg/ml. Po 40 dniach od zakończenia spożywania papai powyższe wartości powróciły do normalnego zakresu bez zmiany dawki lewotyroksyny [Deiana i in., 2012]
Papaja nie jest powszechnie uważana jako produkt mogący zaburzać wchłanianie lewotyroksyny. Chociaż dowody uzyskane z badań są przekonujące, potrzebne są szczegółowe obserwacje na większych grupach osób, które potwierdziłyby trafność tego założenia. Niemniej jednak pacjenci przyjmujący L-tyroksynę powinni mieć na uwadze, że istnieje prawdopodobieństwo, że może ograniczać wchłanianie leku.
Soja
Istnieją doniesienia naukowe mówiące o tym, że częste spożywanie soi u osób z niedoczynnością tarczycy prowadzi do wzrostu hormonu tyreotropowego (TSH).
Przeprowadzono w tym zakresie badanie na niemowlętach, u których ykryto niedoczynność tarczycą. Włączono u nich leczenie lewotyroksyną i podzielono pacjentów na dwie grupy. Pierwsza stosowała, druga nie stosowała produktów sojowych w diecie. Eksperyment nie wykazał istotnych różnic między dwoma grupami w dawce początkowej L-tyroksyny i po roku obserwacji. Wystąpiła natomiast znaczna różnica w obszarach takich jak:
- czas normalizacji TSH,
- pierwszy poziom TSH po wdrożeniu leczenia,
- odsetek ze zwiększonym TSH w 4 miesiącu życia,
- odsetek ze zwiększonym TSH w ciągu pierwszego roku życia,
- w ogólnym trendzie TSH badanym podczas każdej wizyty.
Mechanizm przedłużającego się wzrostu TSH w badaniu jest tłumaczony jako skutek złego wchłaniania i zwiększonej utraty L-T4 wraz z kałem. Możliwe jest również, że soja działa bezpośrednio na tarczycę jako goitrogen [Conrad i in., 2004]. Soja zawiera izoflawony — genisteinę i daidzeninę, które silnie inhibitują tyrozynę katalizowaną przez peroksydazę tarczycową.
Odmienne wyniki wykazało badanie na dorosłych kobietach. Badania przeprowadzone przez Persiani i in. (2015) polegały na podawaniu kobietom po menopauzie, które przyjmują L-tyroksynę, izoflawonów sojowych. Najpierw izoflawony podawano razem z lekiem, natomiast w drugiej części badania po upływie 6 godzin od przyjęcia leku. Po analizie wyników eksperymentu stwierdzono brak istotnych różnic w stężeniu lewotyroksyny w osoczu badanych osób.
Mleko
Chon i in. (2018) opisują, że jednoczesne spożycie mleka zmniejsza wchłanianie lewotyroksyny po podaniu doustnym. PH mleka wynosi około 6,6-6,7 i zawiera mniej niż 1g wapnia/litr. Może to mieć zatem wpływ na absorpcję L-T4. Jednocześnie zawiera tłuszcz, białko i laktozę. Mogą one zatrzymywać lewotyroksynę w świetle jelita, zapobiegając jej wchłanianiu [Virili i in., 2019].
Leki i suplementy diety wpływające na wchłanianie L-tyroksyny
Wiele leków i suplementów może wpływać zarówno na biodostępność wchłanianie, jak i eliminację lewotyroksyny.
Włoscy badacze przeprowadzili dużą analizę wystąpienia interakcji pomiędzy niektórymi lekami a L-tyroksyną. Badanie objęło 5426 osoby, stosujące terapię tym lekiem. Z badań wynika, że podczas początkowej ekspozycji na potencjalny lek, wywołujący interakcje, zauważyć można było znaczny wzrost poziomu TSH, który z czasem malał.
Jednocześnie liczba wypisywanych recept na L-tyroksynę i wysokość dawek leku na początku ekspozycji była niższa. Symetrycznie wzrosły podczas okresu narażenia na nowo podany lek. Dlatego też u pacjentów, stosujących terapię lewotyroksyną, lekarze powinni dokładnie rozważyć dostosowanie leczenia w przypadku jednoczesnego podawania leków, mogących wywołać interakcję [Triffirò i in., 2015].
Do leków zmniejszających wchłanianie LT4 zalicza się:
- ihibitory pompy protonowej (IPP)
- leki zobojętniające nadmiar kwasu solnego (antacida) – są stosowane w chorobach wrzodowych żołądka i dwunastnicy.
- Cholestyramina- środek obniżający poziom cholesterolu wiążąc kwasy żółciowe z metabolitami cholesterolu w jelitach.
- sewelamer i lantan- leki wiążące fosforany, dzięki czemu zapobiegają hiperfosfatemii.
- siarczan żelaza- tworzy nierozpuszczalne kompleksy z lewotyroksyną, zmniejszając jej wchłanianie przez tkanki organizmu
- lowastatyna – lek stosowany w zaburzeniach gospodarki lipidowej.
- węgiel aktywny
- żywice jonowymienne
- orlistat
Przyjmowane leki przez pacjentów mogą także wpływać na metabolizm lewotyroksyny. Leki zwiększające metabolizm LT4 to:
- amiodaron
- leki przeciwpadaczkowe (fenobarbital, fenytoina, karbamazepina)
- sertralina
- inhibitory kinazy tyrozynowej (sunitynib, sorafenib, imatynib, aksytynib, motesanib, vandetanib) [Olejniczak-Rabinek, 2016]
Niżej wymienione suplementy wpływają na wchłanianie L-tyroksyny:
- Witamina C wykazuje zwiększenie wchłaniania lewotyroksyny, co potwierdzają liczne badania naukowe. Jednym z nich jest badanie Antúnez i Licht (2011), gdzie włączono do terapii farmakologicznej u pacjentów, którzy przyjmowali duże dawki L-tyroksyny. Mimo to nie osiągnęli eutyreozy, 1g witaminy C przyjmowanej łącznie z L-T4. TSH u tych pacjentów spadło, a różnica przed i po leczeniu była znacząca. Jubiz i in. (2014) w swoich badaniach podawali pacjentom lewotyroksynę z roztworem kwasu askorbowego (500mg). W wyniku przeprowadzonego badania wykazano pozytywny wpływ witaminy C na wchłanianie LT4. Poziom TSH w surowicy po zastosowaniu kwasu askorbinowego zmniejszał się o 69,2%. Witamina C poprawia nieprawidłowości w poziomach fT3, fT4 i TSH u osób z patologią przewodu pokarmowego. Mechanizmu tego zjawiska nie udało się jednak wyjaśnić. Dlatego zasugerowano, że może to mieć związek ze zwiększoną wchłanialnością leku w środowisku kwaśnym.
- wapń – absorbuje lewotyroksynę i ogranicza jej wchłanianie.
- żelazo – tworzy nierozpuszczalne kompleksy z L-T4.
Podsumowanie
Jeśli istnieje konieczność jednoczesnego przyjmowania wyżej wymienionych leków i L-tyroksyny należy pamiętać o zachowaniu odstępu czasowego w podawaniu tych leków, aby nie występowały interakcje między nimi.
Bibliografia:
- Antúez P.B., Licht S.D.: Vitamin C improves the apparent absorption of levothyroxine in a subset of patients reciving this hormone for primary hypothyroidism. Revista Argentina de Endocrinología y Metabolismo. 2011, 48 (1), 16-24.
- Bach-Huynh T.G., Nayak B., Loh J. Soldin S., Jonklaas J.: Timing of Levothyroxine Administration Aff ects Serum Th yrotropin Concentration. The Journal of Clinical Endocrinology and Metabolism. 2009; 94, 3905–3912.
- Benvenga S., Bartolone L., Pappalardo M. A. Russo A., Lapa D., Giorgianni G., Saraceno G., Trimarchi F.: Altered intestinal absorption of L-thyroxine caused by coffee. Thyroid. 2008, 18, 3, 293-301.
- Biondi B., Wartofsky L.: Treatment With Thyroid Hormone. Endocrine Reviews. 2014; 35: 433–512.
- Cappelli C., Pirola I., Daffini L., Formenti A., Iacobello C., Cristiano A., Gandossi E., Agabiti Rosei E., Castellano M.: A double-blind placebo-controlled trial of liquid thyroxine ingested at breakfast: results of the TICO study. Thyroid. 2016, 26(2), 197–202.
- Cappelli C., Pirola I., Gandossi E., Casella C., Lombardi D., Agosti B., Marini F., Delbarba A., Castellano M.: TSH variability of patients affected by differentiated thyroid cancer treated with levothyroxine liquid solution or tablet form. Hindawi. International Journal of Endocrinology, 2017, 7053959.
- Chon D.A., Reisman T., Weinreb J.E., Hershman J.M., Leung A.M.: Concurrent milk ingestion decreases absorption of levothyroxine. Thyroid. 2018;28(4):454–457
- Conrad S.C., Chiu H., Silverman B. L.: Soy formula complicates management of congenital hypothyroidism. Archives of Disease in Childhood. 2004, 89, 37-40.
- Deiana L., Marini S., Mariotti S.: Ingestion of large amounts of papaya fruit and impaired effectiveness of levothyroxine therapy. Endocrine Practice. 2012;18(1):98–100
- Fallahi P., Ferrari S.M., Camastra S., Politti U., Ruffilli I., Vita R., Navarra G., Benvenga S., Antonelli A.: TSH normalization in bariatric surgery patients after the switch from L-thyroxine in tablet to an oral liquid formulation. Obesity Surgery. 2017, 27(1), 78–82.
- Formenti A.M., Mazziotti G., Giubbini R., Giustina A.: Treatment of hypothyroidism: all that glitters is gold? Endocrine. 2016, 52(3), 411–413.
- Garber J.R, Cobin R.H., Gharib H., Hennessey J.V., Klein I., Mechanick J. I., Pessah-Pollack R., Singer P., Woeber K.A.: Clinical practice guidelines for hypothyroidism in adults: cosponsored by the Ameican Association of Clinical Endocrinologists and the Americal Thyroid Associantion. Endocrine Practice. 2012, Vol. 18, No. 6, 988-1028.
- Irokoze L., Tang S., Astère M., Wang K.R, Deng S., Xiao L., Li Q.F.: Liquid L-thyroxine versus tablet L-thyroxine in patients on L-thyroxine replacement or suppressive therapy: a meta-analysis. Endocrine. 2018, 61: 28-35.
- Jubiz W., Ramirez M.: Eff ect of Vitamin C on the Absorption of Levothyroxine in Patients With Hypothyroidism and Gastritis. The Journal of Clinical Endocrinology and Metabolism. 2014; 99: E1031–E1034
- Kostkowski W., Herman Z.S.: Farmakologia. Podstawy farmakoterapii. Podręcznik dla studentów medycyny i lekarzy. Tom I. Wydawnictwo Lekarskie PZWL. Warszawa 2010, 347-352.
- Lilja J.J., Laitinen K., Neuvonen P.J.: Effects of grapefruit juice on the absorpyion of levothyroxine. British Journal of Clincal Pharmacology. 2005, 60, 3, 337-341.
- Morelli S., Reboldi G., Moretti S., Menicali E., Avenia N., Puxeddu E.: Timing of breakfast does not influence therapeutic efficacy of liquid levothyroxine formulation. Endocrine. 2016, 52(3), 571–578.
- Olejniczak-Rabinek M.: Czynniki wpływające na dostępność biologiczną lewotyroksyny. Farmacja współczesna. 2016, 9, 194-201.
- Okosieme O.E., Belludi1 G., Spittle K. Kadiyala R., Richards J.: Adequacy of thyroid hormone replacement in a general population. QJM: An International Journal of Medicine. 2011; 104:395–401.
- ŐstaşE., Garcia-Saavedra A.P., Yanar F., Őzçinar B., Aksakal N., Purisa S., Őzhan G.: P-glycoprotein polymorphism and levothyroxine bioavailability in hypothyroid patients. Studi Pharmaceutical Jurnal. 2018, 26, 274-278.
- Pang X., Pu T., Xu L., Sun R.: Effect of l-thyroxine administration before breakfast vs at bedtime on hypothyroidism: A meta-analysis. Clinical Endocrinology. 2020, 92, 475-481.
- Persiani S., Sala F., Manzotti C., Colovic M., Zangarini M., Donazzolo Y., Barbetta B., Vitalini C., Giacovelli G., Benvenuti C., Rovati L.C.: Evaluation of Levothyroxine Bioavailability after Oral Administration of a Fixed Combination of Soy Isoflavones in Post-menopausal Female Volunteers. Drug Research, 2016, 66 (3), 136-140.
- Pirola I., Formenti A.M., Gandossi E., Mittempergher F., Casella C., Agosti B., Cappelli C.: Oral liquid L-thyroxine (L-t4) may be better absorbed compared to L-T4 tablets following bariatric surgery. Obesty Surgery. 2013, 23(9), 1493–1496.
- Ribichini D., Fiorini G., Repaci A., Castelli V., Gatta L., Vaira D., Pasquali R.: Tablet and oral liquid L-thyroxine formulation in the treatment of naïve hypothyroid patients with Helicobacter pylori infection. Endocrine. 2017, 57(3), 394–401.
- Skelin M., LucijanićT., Amidžić-Klarić D., Reŝić A., Bakula M., Liberati-Čizmek A.-M., Gharib H., Rahelić D.: Factors Affecting Gastrointestinal Absorption of Levothyroxine: A Review. Clinical Therapeutics. 2017, 39 (2), 378-403.
- Triffirò G., Parrino F., Sultana J. i in., Drug interactions with Levothyroxine therapy in patient with hypothyroidism: observational study in general practice. Clinical Drug Investigation. 2015, 35:187-195
- Van Middlesworth L. :Thyroxine excretion, a possible cause of goiter. Endocrinology. 1957, 61(5), 570–573.
- Vita R., Saraceno G., Trimarchi F., Benvenga S.: A novel formulation of L-thyroxine (L-T4) reduces the problem of L-T4 malabsorption by coffee observed with traditional tablet formulations. Endocrine. 2013. 43, 154-160
- Vita R., Fallahi P., Antonelli A., Benvenga S.: The administration of L-thyroxine as soft gel capsule or liquid solution. Expert Opinion on Drug Delivery. 2014, 11(7), 1103–1111.
- Virili C., Antonelli A., Santaguida M. G., Bevenga S., Centanni M.: Gastrointestinal malabsorption of thyroxine. Endocrine Reviews. 2019, 40 (1), 118-136.







