Dieta jest ważnym czynnikiem wpływającym na rozwój i zdrowie człowieka. Zmiana współczesnego trybu życia na siedzący oraz łatwa dostępność wysokokalorycznej żywności doprowadziła do rozwoju powszechnie występującej otyłości i jej zdrowotnych konsekwencji. Pomimo zmian w diecie genotyp człowieka nie ewoluuje tak szybko. Nasz organizm preferuje oszczędny tryb, skłonny do magazynowania energii, która jeśli nie jest wydatkowana, przyczynia się do rozwoju chorób cywilizacyjnych.
W odpowiedzi na stosowaną dietę, reakcja metaboliczna różnych organizmów ludzkich może być odmienna. O zróżnicowaniu stanu zdrowia, warunkowanego dietą i czynnikami środowiskowymi, decyduje zmienność sekwecji genomu człowieka, sięgająca ok. 0,1 % między pojedynczymi osobnikami. Za zmienność tą odpowiadają głównie poliformizmy pojedynczego nukleotydu (z ang. SNP – single nucleotide polyphormism). To na nich skupiają się badania interakcji gen-dieta.
Poliformizm SNP polega na zamianie jednego nukleotydu na inny w nici DNA, co może skutkować zmianą aktywności kodowanego białka, zwiększeniem bądź zmniejszeniem ekspresji genu czy nawet powstaniem niefunkcjonalnego białka. Szacuje się, że ludzki genom zawiera ponad 10 mln poliformizmów SNP, a każdy człowiek posiada ich unikalny dla siebie wzór. Wybrane poliformizmy SNP mogą wpływać na zapotrzebowanie enrgetyczne czy metabolizm składników odżywczych, a także na apetyt czy ryzyko rozwoju dietozależnych chorób przewlekłych [1].
Genomika żywieniowa i technologie „omics”
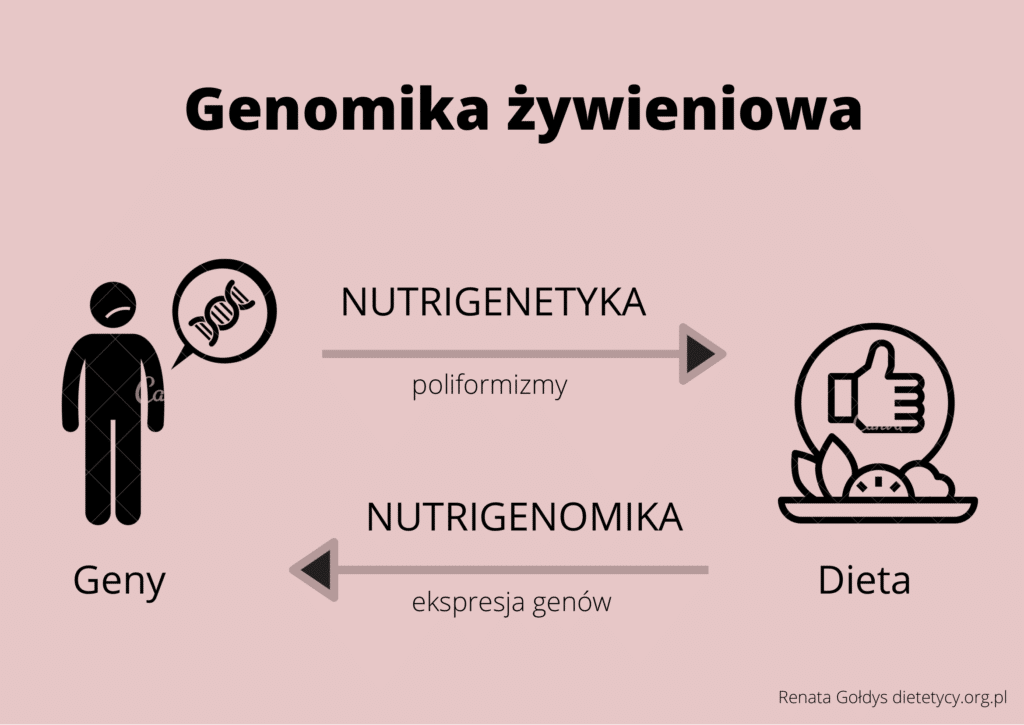
Nauka, która zajmuje się badaniem związku między wariantami genów a składnikami pożywienia w aspekcie wpływu na zdrowie, nazywana jest nutrigenetyką. Występuje także odwrotna interakcja pożywienia na ekspresję genów, zaś nauka, która bada to zjawisko to nutrigenomika. Wpływ składników pokarmowych na zmiany epigenetyczne (chemiczna modyfikacja DNA, bez zmian w sekwencji) opisuje epigenomika żywieniowa. Dziedziny te wchodzą w skład genomiki żywieniowej, która charakteryzuje dwukierunkowe oddziaływanie genów z dietą.
Wyżej wymienione obszary nauk są wspomagane przez nowe techniki badawcze typu omics, do których należą: tranksryptomika, proteomika i metabolomika, zajmujące się kolejno analizą transkryptów mRNA, ekspresją i funkcją białek oraz metabolitami obecnymi w organizmie człowieka [1,2]. Poznanie genetycznego podłoża dietozależnych chorób cywilizacyjnych, dzięki rozwojowi nauk genomiki żywieniowej, może pozwolić w przyszłości na indywidualizację zaleceń dietetycznych w celu zmninimalizowania ryzyka wystąpienia chorób [3].
Zastosowanie nutrigenetyki w leczeniu dietozależnych chorób monogenowych
Podejście nutrigenetyczne jest już używane w praktyce klinicznej w leczeniu chorób dietozależnych monogenowych. Najbardziej znanym przykładem jest celiakia – choroba trzewna polegająca na braku tolerancji glutenu z diety. Podstawą leczenia tej choroby jest wyeliminowanie podaży tego składnika, co chroni przed powstaniem stanu zapalnego i uszkodzeniem kosmków jelitowych. Predyspozycja genetyczna, a mianowicie nosicielstwo genów HLA-DQ2 i HLA-DQ8, jest konieczne do wystąpienia celiakii, ale nie wystarczające (potrzebny jest także udział czynników środowiskowych). Tylko przestrzeganie ścisłej diety bezglutenowej od momentu rozszerzania diety niemowlęcia może uchronić przed negatywnymi skutkami zdrowotnymi związanymi z rozwojem celiakii [1,2].
Do innych chorób metabolicznych z predyspozycją genetyczną należą: fenyloketonuria, galaktozemia oraz wrodzona nietolerancja laktozy czy alkoholu. Schorzenia te polegają na obniżeniu aktywności bądź niedoboru enzymów metabolizujących aminokwasy, cukry proste bądź alkohol, w wyniku wadliwych wersji genów kodujących białka enzymatyczne, dlatego dieta pacjentów z tymi chorobami powinna eliminować wybrane związki [1].
Zespół metaboliczny
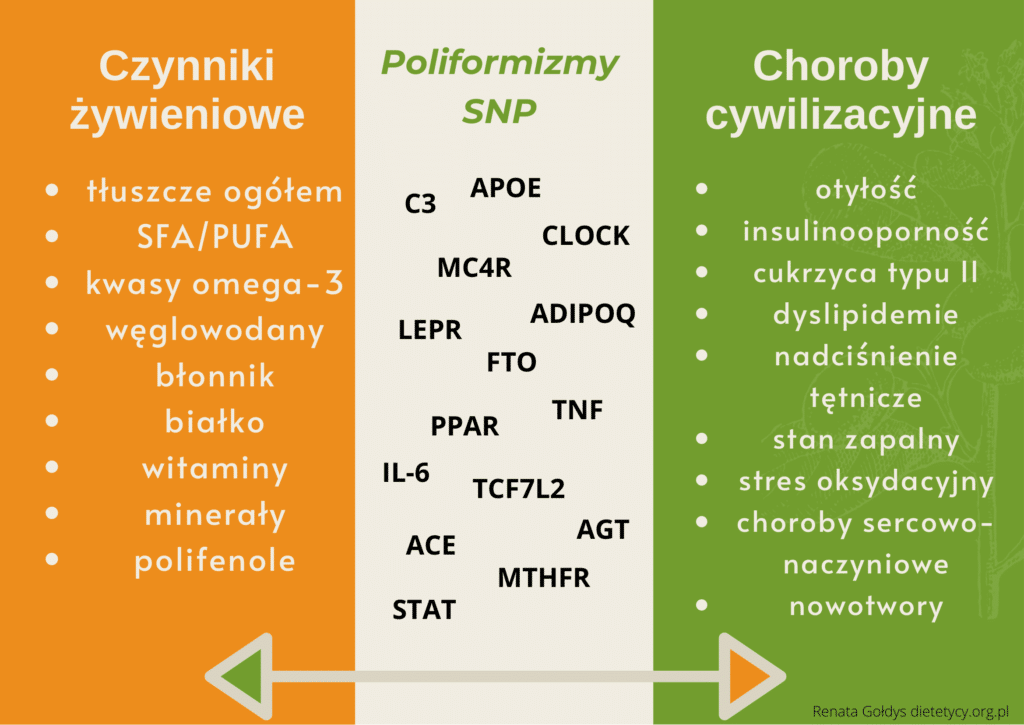
Zespół metaboliczny (ZM) to zbiór wzajemnie powiązanych czynników zwiększających istotnie ryzyko rozwoju miażdżycy i cukrzycy typu 2 oraz ich powikłań naczyniowych. Łączy on zaburzenia metaboliczne takie jak: otyłość brzusna (wisceralna), dyslipidemia aterogenna – podwyższone stężenie trójglicerydów i obniżone stężenie cholesterolu HDL, upośledzenie tolerancji glukozy – podwyższone stężenie glukozy na czczo/insulinooporność oraz nadciśnienie tętnicze. Predysponują one nie tylko do wystąpienia chorób sercowo-naczyniowych i cukrzycy typu 2, ale też do rozwoju nowotworów. Sposób żywienia ma kluczową rolę w rozwoju lub zapobieganiu wystąpienia zespołu metabolicznego. Szczególnie ilość spożywanych tłuszczów i ich rodzaj jest istonym czynnikiem wpływającym na ZM. Inne składniki diety, takie jak: węglowodany i błonnik czy sód także mogą brać udział w patogenezie ZM [1,4].
Poniżej zostaną opisane wybrane interakcje poliformizmów genów SNP związane z rodzajem spożywanych składników pokarmowych, głównie kwasów tłuszczowych, z podziałem na poszczególne składowe zespołu metabolicznego. Identyfikacja tych wielogenowych predyspozycji genetycznych chorób cywilizacyjnych, może znacząco ułatwić ich prewencję, dopasowaną do każdego pacjenta.
Wpływ poliformizmów genów na występowanie składowych ZM
1) Otyłość, insulinooporność i cukrzyca typu II
Istnieje wiele dowodów przemiawiających za udziałem czynników genetycznych w występowaniu otyłości. Określone polimorfizmy poszczególnych genów mogą sprzyjać nadmiernemu gromadzeniu tkanki tłuszczowej w wyniku zaburzeń regulacji bilansu energetycznego. Dziedziczność BMI i odsetka tkanki tłuszczowej może wynosi nawet 25-40 %, lecz sam czynnik genetyczny nie jest wystarczający do zachorowania. Wśród poliformizmów genów związanych z otyłością możemy wyróżnić geny kodujące: hormony jelitowe (grelina, leptyna, cholecystokinina), centralne regulatory przyjmowania pokarmu (białko Aguti, neuropeptyd Y i białka szlaku melanokortynowego), modulatory wydatkowania energii (białka rozprzęgające UCP) oraz regulatory wzrostu adipocytów i inne [1,5].
Mutacje w genach kodujących leptynę (LEP) i jej receptor (LEPR).
Warianty genetyczne związane z częstszym występowaniem zespołu metabolicznego wiązały się z trudnością utraty nadmiernej masy ciała i mniejszym stężeniem leptyny, która jest hormonem sytości. Niskie stężenie wielonienasyconych kwasów tłuszczowych (PUFA) z grupy n-3 i wysokie n-6 PUFA w osoczu korelowało ze zwiększonym ryzykiem hiperinsulinemii i insulinooporności u homozygot GG. W modelu zwierzęcym wykazano również, że suplementacja witaminą E powodowała istotny wzrost ekspresji zarówno leptyny, jak i adiponektyny u otyłych szczurów [1].

Mutacje genu receptora melanokortynowego-4 (MC4R).
Skutkiem tej mutacji jest wzrost uczucia głodu i występowania hiperfagii u dzieci. Dla wybranych markerów MC4R zaobserwowano, że otyłe dzieci będące ich nosicielami wykazują chęć nadmiernego jedzenia, przede wszystkim słodyczy i po ich spożyciu odczuwają z tego względu satysfakcję. Inne badania wskazują jakoby osoby z allelem rs17782313 preferowały dietę bogatotłuszczową, kosztem podaży węglowodanów i białek [1].
Mutacje genu adiponektyny (ADIPOQ)
U otyłych pacjentów obserwuje się obniżenie ekspresji genu adiponektyny i zmniejszenie stężenia tego przeciwzapalnego hormonu we krwi. Dla wybranych wariantów ADIPOQ stwierdzono, że spożycie jednonienasyconych kwasów tłuszczowych powyżej 13 % udziału energii, skutkuje zwiększeniem BMI i wzrostem stężenia wskaźnika HOMA-IR i ryzykiem wystąpienia cukrzycy typu II, zwłaszcza u osób ze sprzyjającym ku temu allelowi genu CLOCK [5].
Mutacje genu kodującego receptor aktywowany proliferatorami peroksysomów typu γ (PPARγ)
PPAR uczestniczą w wielu procesach metabolicznych, m.in.: różnicowaniu się adipocytów, metabolizmie lipidów, homeostazie glukozy i insuliny. Wykazano, że poliformizm Pro12Ala ma udział w rozwoju otyłości, dyslipidemii, nadciśnienia tętniczego, cukrzycy oraz ma związek ze stężeniem leptyny i adiponektyny. U osób będących homozygotami Pro12/Pro12 stwierdzono zaś zależność między spożyciem wielonienasyconych kwasów tłuszczowych a obniżeniem ryzyka wystąpienia zawału serca. Nosiciele Ala12 mają natomiast niższe ryzyko cukrzycy i są mniej narażeni na wystąpienie dyslipidemii [1,6].
Gen FTO (gen podatności na otyłość)
Polimorfizm rs9939609 genu FTO jest związany ze zwiększonym łaknieniem i spożywaniem kalorii, większą masą ciała i wskaźnikiem BMI. Nosiciele tego allelu mają obniżoną wrażliwość na insulinę i wyższe stężenie leptyny we krwi, co stanowi ryzyko rozwoju cukrzycy. Poliformizm ten koreluje również ze stężeniem białka C-reaktywnego, świadczącego o występowaniu stanu zapalnego w organizmie [3,5,7].
Stwierdzono także, że przy wysokiej podaży nasyconych kwasów tłuszczowych (> 15,5 % energii) i ich dominacją w diecie nad wielonienasyconymi kwasami tłuszczowymi, zwiększa się ryzyko otyłości. Inny polimorfizm genu FTO – rs17817449, związany był nie tylko z większą masą ciała u dzieci, ale również z wyższym stężeniem trójglicerydów i cholesterolu całkowitego oraz glukozy na czczo [1,7].
Gen TCF7L2 (kodujący czynnik transkrypcyjny w procesie sekrecji insuliny)
Wykazano związek dwóch wariantów tego genu: rs12255372 i rs7903146 z częstszym występowaniem cukrzycy typu II, co wynikało z zaburzenia pracy komórek β-trzuski i nieprawidłowego wydzielania insuliny oraz ze zwiększonej oparności tkankowej na ten hormon. Jednak po wprowadzeniu działań prewencyjnych (zalecenia dietetyczne i aktywność fizyczna) zaobserwowano, że efekt procukrzycowy zostawał zniesiony [3,8].
Można wyróżnić znacznie więcej poliformizmów genów związanych z otyłością i cukrzycą typu II – już po tej pory zidentyfikowano ich przynajmniej kilkadziesiąt. Do bardziej znanych należą warianty genetyczne czynnika traskrypcyjnego STAT3 (związanego z otyłością brzuszną), regulatora transkrypcyjnego CLOCK (korelującego z wielkością spożycia żywności, objadaniem się, zaburzeniami snu czy insulinoopornością), białka transportującego cynk SLC30A8 (związek z upośledzoną tolerancją glukozy przy niskim stężeniu cynku we krwi) czy substratu receptora insuliny IRS1 (rzadziej występująca insulinooporność przy wysokim stężeniu witaminy D) [1,8].
Mnogość genów mogących wpływać na wystąpienie otyłości i cukrzycy insulinoniezależnej i dodatkowo modulujące je czynniki środowiskowe (m.in. podaż składników pokarmowych) wymagają dalszego potwierdzenia w badaniach na dużych grupach osób, aby móc w praktyce wykorzystać podejście nutrigenetyczne w celu lepszej indywidualizacji tych schorzeń.
2) Dyslipidemie
Do genów zaangażowanych w metabolizm tłuszczów i lipidów należą m.in.: alipoproteiny, będące transporterami cholestorolu we krwi, lipaza lipoproteinowa i wątrobowa oraz enzymy związane z koenzymem A (odpowiadające za komórkowy metabolizm kwasów tłuszczowych), czynniki jądrowe (m.in. czynnik martwicy nowotworów α – TNF-α) i receptory PPAR- α (aktywowane przez proliferatory peroksysomów). Poliformizmy genów tych białek mogą przyczynić się do powstania dyslipidemii, miażdżycy i w konsekwencji chorób sercowo-naczyniowych [1,7].
Apolipoproteina E (APOE)
Obecność allelu E4 tego genu wykazuje największą zależność wpływu diety bogatej w nasycone kwasy tłuszczowe i cholesterol na steżenie cholesterolu LDL we krwi i zwiększenie ryzyka chorób sercowo-naczyniowych. Wariant ten jednocześnie jest najbardziej podatny na zastosowanie diety niskotłuszczwej, co wskazuje na ważny element prewencyjny. Wykryto związek allelu E4 ze zwiększonym ryzykiem rozwoju choroby Alzheimera oraz jego udział w patogenezie choroby Parkinsona, związaną ze zwiększoną peroksydacją lipidów [2,9].
Apolipopoteina A-IV (APO4)
Mutacja w pozycji A347T, w częściej występującej w populacji kaukaskiej izoformie genu apoA-IV-1, skutkuje znaczną poprawą lipidogramu przy zastosowaniu diety niskotłuszczowej z wysokim udziałem jednonienasyconych kwasów tłuszczowych (obniżenie trójglicerydów i cholesterolu LDL). Izoforma apoA-IV-2 ma związek z wyższym poziomem HDL-cholesterolu i niższym poziomem trójglicerydów. Jej mutacja w pozycji G360T warunkuje jednak obniżenie stężenia HDL na diecie bogatej w nasycone kwasy tłuszczowe. Wykazano także zwiększenie aterogenności osocza przy wysokim spożyciu węglowodanów oraz odwortną korelację dla jednonienasyconych kwasów tłuszczowych [1].
Apolipoproteina A1 (APOA1) i apolipoproteina B (APOB)
Wybrane warianty tych genów prowadzą do zwiększenia występowania zespołu metabolicznego wśród osób stosujących dietę bogatotłuszczową (> 35 % energii). Dodatkowo wysoka podaż jednonienasyconych kwasów tłuszczowych zwiększa to ryzyko. Na diecie z niższą zawartością tłuszczów korelacja ta nie była obserwowana [1].
Receptor alfa aktywowany przez proliferatory peroksysomów (PPAR-α)
Powszechnie występujący poliformizm genu PPAR-α 484G jest odwrotnie związany ze stężeniem trójglicerydów w odpowiedzi na podaż wielonienasyconych kwasów tłuszczowych [1].
Karboksylaza acetylo-CoA (ACC2)
W wyniku zaburzenia pracy tego enzymu, który bierze udział w syntezie kwasów tłuszczowych, dochodzi do zwiększenia ryzyka zespołu metabolicznego w przypadku diety wysokotłuszczowej z wysokim udziałem n-6 [1].
Długołańcuchowa acyl-CoA syntetaza (ACSL1)
Jeden z genotypów tego enzymu warunkuje wyższą zapadalność na zespół metaboliczny w wyniku powstawania dyslipidemii i insulinooporności przez zaburzoną oksydację mitochondrialną kwasów tłuszczowych. Ryzyko może to jednak być zmniejszone dzięki zastosowaniu diety niskotłuszczowej lub z wysoką podażą wielonienasyconych kwasów tłuszczowych [1].
Tak jak w przypadku otyłości i cukrzycy typu II, istnieje wiele poliformizmów SNP, mających udział w patogenezie dyslipidemii. Oprócz wymieniowych wyżej wariacji genowych, można wskazać poliformizmy genów kodujących m.in. śródbłonkową syntazę tlenku azotu (eNOS) i lipazę wątrobową (HL) jako enzymy, które odpowiadają pozytywnie na wysoki udział wielonienasyconych kwasów tłuszczowych (o działaniu kardioprotekcyjnym) w diecie [1].

3) Nadciśnienie
Wiele czynników genetycznych ma swój udział w regulacji ciśnienia tętniczego, a niektóre mutacje genowe mogą prowadzić nawet do rozwoju nadciśnienia. Podłoże środowiskowe, zwłaszcza spożycie soli, modyfikuje ryzyko nabycia nadciśnienia, zależnie od posiadanych poliformizmów SNP związanych z obrotem sodu w organizmie. Geny układu hormonalnego renina-angiotensyna-aldosteron (RAA) mają największy udział w utrzymywaniu prawidłowego ciśnienia tętniczego krwi i to ich mutacje odpowiadają za zwiększoną/zmniejszoną sodowrażliwość [1].
Angiotensynogen (AGT)
Angiotensynogen jest prekursorem angiotensyny II, który podwyższa ciśnienie krwi w wyniku zwiększonego wchłaniania sodu i jego zwiększonej resorpcji w nerkach. Wykazano, że posiadacze allelu A w miejscu rs5051 mają zwiększoną ekspresję tego genu, co skutkuje podwyższeniem ciśnienia tętniczego w odpowiedzi na dietę wysokosodową. Jednak zastosowanie diety DASH u tych nosicieli znacząco obniża ciśnienie. Homozygoty GG są zaś sodoodporne – tzn. powstanie nadciśnienia nie jest u nich zależne od spożycia soli [1,9].
Receptor angiotensyny II typu 1 (AGTR1)
Nosiciele allelu C genu AGTR1 są bardziej sodowrażliwi ze względu posiadania większej liczby receptorów angiotensyny [1].
Enzym konwertujący angiotensynę (ACE)
Odpowiada za przekszatłcenie angiotensyny w jej aktywną formę, podwyższającą ciśnienie krwi. Osoby posiadające poliformizm DD genu ACE mają prawie 2-krotnie wyższą aktywność tego enzymu, co czyni je bardziej wrażliwymi na sód. Są one przez to obciążone wyższym ryzykiem wystąpienia nadciśnienia tętniczego. Jednakże w wyniku utraty nadmiernej masy ciała, także nosiciele DD, w największym stopniu redukują ciśnienie.
Za powstawanie sodowrażliwego nadciśnienia mogą odpowiadać również geny związane z transportem (kanały sodowe) i metabolizmem sodu w komórkach. Należą do nich: gen kinazy 1 regulującej glikokortykoidy w surowicy (SGK1) oraz gen SLC4A5 (kotransporter sodu i węglowodanów typu 4) [1].
Opisane powyżej zależności nutrigenetyczne mogą wyjaśniać, dlatego niektórzy pacjenci reagują na leczenie nadciśnienia tylko dietą, a inni potrzebują preparatów farmaceutycznych.
4) Stan zapalny i stres oksydacyjny
Przewlekły stan zapalny i nadmierny stres oksydacyjny, prowokowane przez wysokokaloryczną i wysokotłuszczową dietę oraz towarzyszące otyłości wisceralnej, zwiększają ryzyko chorób cywilizacyjnych i są ich wspólnym wykładnikiem.
Poliformizmy genów cytokin prozapalnych, takich jak: TNF-α czy IL-6 i IL-1β, oraz limfotoksyny α mogą predysponować do wystąpienia zespołu metablicznego, cukrzycy typu II i wybranych nowotworów. Zaobserwowano, że przy wysokim spożyciu wielonienasyconych kwasów tłuszczowych do nasyconych następuje jednak poprawa profilu metabolicznego i obniżenie ryzyka wymienionych chorób [1,10,11].
Innym genem, którego wariacja może przyczynić się do powstania zapalenia, jest składnik dopełniacza C3. Związany jest także z ryzykiem zespołu metabolicznego: insulinoopornością, dyslipidemią i otyłością brzuszną. Ryzyko to podlega regulacji dietą niskotłuszczową bądź z dużą zawartością kwasów omega-3 [1,4].
Indywidualna zmienność genetyczna w endogennym systemie obrony przeciwutleniaczy może wpływać na zmniejszenie lub zwiększenie stresu oksydacyjnego i różny rozwój choroby. Występowanie SNP genów, takich jak: dysmutaza ponadtlenkowa (SOD), katalaza (CAT), peroksydaza glutationowa (GPX), selenoproteina P (SeP), tioredoksyna (TXN) oraz O-metylotransferaza katecholowa (COMT) osłabia enzymatyczną aktywność obronną organizmu przed stresem oksydacyjnym i może spowodować wystąpienie stanu zapalnego i dyslipidemii. Aktywność tych genów może być regulowana poprzez podaż antyoksydantów z diety – m.in. selen lub witaminę E, A i C [5,10,11].
Nutrigenetyka w praktyce
Najbardziej znanym w literaturze naukowej przykładem praktycznego podejścia nutrigenetycznego w leczeniu otyłości i jej powikłań jest eksperyment medyczny dr Arkadianosa. Zrekrutował on do badania nutrigenetycznego pacjentów, którzy mieli ≥ 2 prób nieudanego odchudzania. U osób badanych (50 osób) przeanalizowano 24 SNP w 19 genach związanych z procesami metabolicznymi (związane w przemianami tłuszczów, gospdarką insulinową, stanem kości, stresem oksydacyjnym i metabolizmem folianów), a na ich podstawie otrzymali oni zalecenia dietetyczne i dotyczące aktywności fizycznej. Grupa kontrolna miała stosować się do diety śródziemnomorskiej. Po 90 dniach eksperymentu zaobserwowano znaczne obniżenie glukozy na czczo w grupie nutrigenetycznej. Po okresie połowy roku nie wykazano znaczących różnic, lecz po 300 dniach w grupie badanej stwierdzono większą redukcję masy ciała, a uzyskana waga utrzymywała się przez następny rok. Badania przeprowadzone w Nowej Zelandii z udziałem osób otyłych także potwierdzają skuteczność zaleceń opartych na badaniach nutrigenetycznych w trwałej redukcji masy ciała [1,2].
Mimo tych obiecujących wyników badań, obecna wiedza z zakresu genomiki żywieniowej jest niewystarczająca, aby postępowanie nutrigenetyczne było wykorzystywane w codziennej praktyce lekarzy i dietetyków w celu indywidualizacji diety. Na ten moment powinniśmy się opierać na ogólnopopulacyjnych normach i zaleceniach żywieniowych, uwzględniających poziom aktywności fizycznej, wiek, płeć oraz stan fizjologiczny (ciąża i laktacja), zwłaszcza, że w większości przypadków są one kompatybilne do zaleceń nutridietetycznych [3,9].
Testy nutrigenetyczne
Profil genetyczny pacjenta może być źródłem informacji dotyczących odpowiedzi metabolicznych organizmu na składniki pokamowe. Na ich podstawie opracowana może być indywidualna dieta oraz dopasowana suplementacja, która pozwoliłaby na skutecznejszą prewencję i leczenie chorób dietozależnych, co zaś przyczyniłoby się do poprawy zdrowia publicznego. Zastosowanie podejścia nutrigenetycznego będzie jednak możliwe dopiero w przyszłości. Interakcje między genami i dietą są dwukierunkowe, złożone i do tej pory nie do końca poznane. Wymagana jest większa liczba badań klinicznych z wykorzystaniem testów nutrigenetycznych, aby potwierdzić ich skuteczność i zasadność zastosowania tych technik w poradnictwie dietetycznym [9,12].
Należy pamiętać również, że predyspozycje genetyczne schorzeń dietozależnych nie warunkują wystąpienia danej choroby, lecz odpowiadają tylko częściowo za zwiększenie ryzyka jej wystąpienia. Wykonując więc test nutrigenetyczny, trzeba wziąć pod uwagę, że inne czynniki środowiskowe (aktywność fizyczna, tryb i miejsce pracy, stosowanie używek, zanieczyszczenia powietrza i inne) mogą modyfikować korzystny efekt zastosowania spresonalizowanych zaleceń [12].
Na rynku polskim zaczęły pojawiać się pakiety badań nutrigenetycznych oferowanych przez laboratoria diagnostyczne, lecz ich wysoki koszt rzędu 1-3 tys zł oraz niska dostępność i wiarygodność nie przyciągają na razie wielu zwolenników. Testy można wykonać w kraju prywatnie, bez skierowania od lekarza i często bez późniejszej konsultacji po ich wykonaniu. Aby stały się one częścią diagnostyki prewencyjnej, istnieje potrzeba stworzenia zespołów interdyscyplinarnych, do których należeliby nutrigenetyk, lekarz, dietetyk oraz diagnosta laboratoryjny, oraz laboratioriów diagnostyki genetycznej o wysokich standardach przeprowadzania badań i ściśle chroniących dane pacjenta.
Do kompleksowej usługi nutrigenetycznej potrzebny jest nie tylko test badający wiele poliformizmów genów, których wpływ na metabolizm człowieka jest udowodniony naukowo, ale także konsultacje z zespołem specjalistów, który brałby czynny udział w zmianach zdrowotnych pacjenta i praktycznie przedstawił indywidualnie przygotowane zalecenia. Obecnie jest jednak za wcześnie na zastosowanie testów nutrigenetycznych w praktyce. W celu zapobiegania chorób dietozależnych, zgodnie z obecnym stanem wiedzy, rekomendujemy stosowanie zasad zdrowego odżywiania, regularną umiarkowaną aktywność fizyczną oraz rezygnację z używek.
Podsumowanie
Niezaprzeczalnym faktem, dotyczącym czynników ryzyka chorób cywilizacyjnych, jest to, że zarówno predyspozycje genetyczne (poliformizmy SNP w genach związanych z metabolizmem), jak i czynniki środowiskowe (zanieczyszczenia powietrza, używki) oraz całokształt trybu życia, mają swój udział w rozwoju schorzeń dietozależnych. Zanim jednak testy nutrigenetyczne staną się powszechnym narzędziem w diagnostyce prewencyjnej, które posłużą do układania zindywidualizowanej diety i suplementacji, potrzeba więcej dowodów naukowych potwierdzających ich skuteczność.
Piśmiennictwo
- Sadakierska-Chudy, A. (2018). Nutrigenetyka. [W:] Poniewierka, E. (red.). Dietetyka oparta na dowodach. (s. 67-117). Wrocław: MedPharm Polska.
- Panczyk, M. (2013). Nutrigenetyka i nutrigenomika–zastosowanie technologii „omics” w optymalizacji żywienia człowieka. Pediatric Endocrinology, Diabetes and Metabolism, 19(2), 70-77.
- Koszowska, A., & Ebisz, M. (2015). Rozwój nauk o żywności i żywieniu—od norm żywienia do genomiki żywienia. In Forum Zaburzeń Metabolicznych, 6(3), 85-93.
- Phillips, C. M. (2013). Nutrigenetics and metabolic disease: current status and implications for personalised nutrition. Nutrients, 5(1), 32-57.
- Bobrowska-Korczak, B., Skrajnowska, D., & Orzoł, A. (2017). Rola nutrigenomiki we wspomaganiu leczenia otyłości. Postepy Hig Med Dosw (online), 71, 1080-1088.
- Adamska, E., & Ostrowska, L. (2010). Nutrigenetyka i nutrigenomika a leczenie otyłości i chorób towarzyszących. Forum Zaburzeń Metabolicznych, 1(3), 156-167.
- Peña-Romero, A. C., Navas-Carrillo, D., Marín, F., & Orenes-Piñero, E. (2018). The future of nutrition: nutrigenomics and nutrigenetics in obesity and cardiovascular diseases. Critical reviews in food science and nutrition, 58(17), 3030-3041.
- Berná, G., Oliveras-López, M. J., Jurado-Ruíz, E., Tejedo, J., Bedoya, F., Soria, B., & Martín, F. (2014). Nutrigenetics and nutrigenomics insights into diabetes etiopathogenesis. Nutrients, 6(11), 5338-5369.
- Kapka-Skrzypczak, L., Niedźwiecka, J., Cyranka, M., Kruszewski, M. K., Skrzypczak, M., & Wojtyła, A. (2011). Nutrigenetyka-perspektywy żywienia zindywidualizowanego. Pediatric Endocrinology, Diabetes & Metabolism, 17(4), 222-226.
- Da Costa, L. A., Badawi, A., & El-Sohemy, A. (2012). Nutrigenetics and modulation of oxidative stress. Annals of Nutrition and Metabolism, 60(3), 27-36.
- Curti, M. L. R., Jacob, P., Borges, M. C., Rogero, M. M., & Ferreira, S. R. G. (2011). Studies of gene variants related to inflammation, oxidative stress, dyslipidemia, and obesity: implications for a nutrigenetic approach. Journal of Obesity, 2011, 497401.
- Ferguson, L. R., De Caterina, R., Görman, U., Allayee, H., Kohlmeier, M., Prasad, C., … & Kang, J. X. (2016). Guide and position of the international society of nutrigenetics/nutrigenomics on personalised nutrition: part 1-fields of precision nutrition. Lifestyle Genomics, 9(1), 12-27.