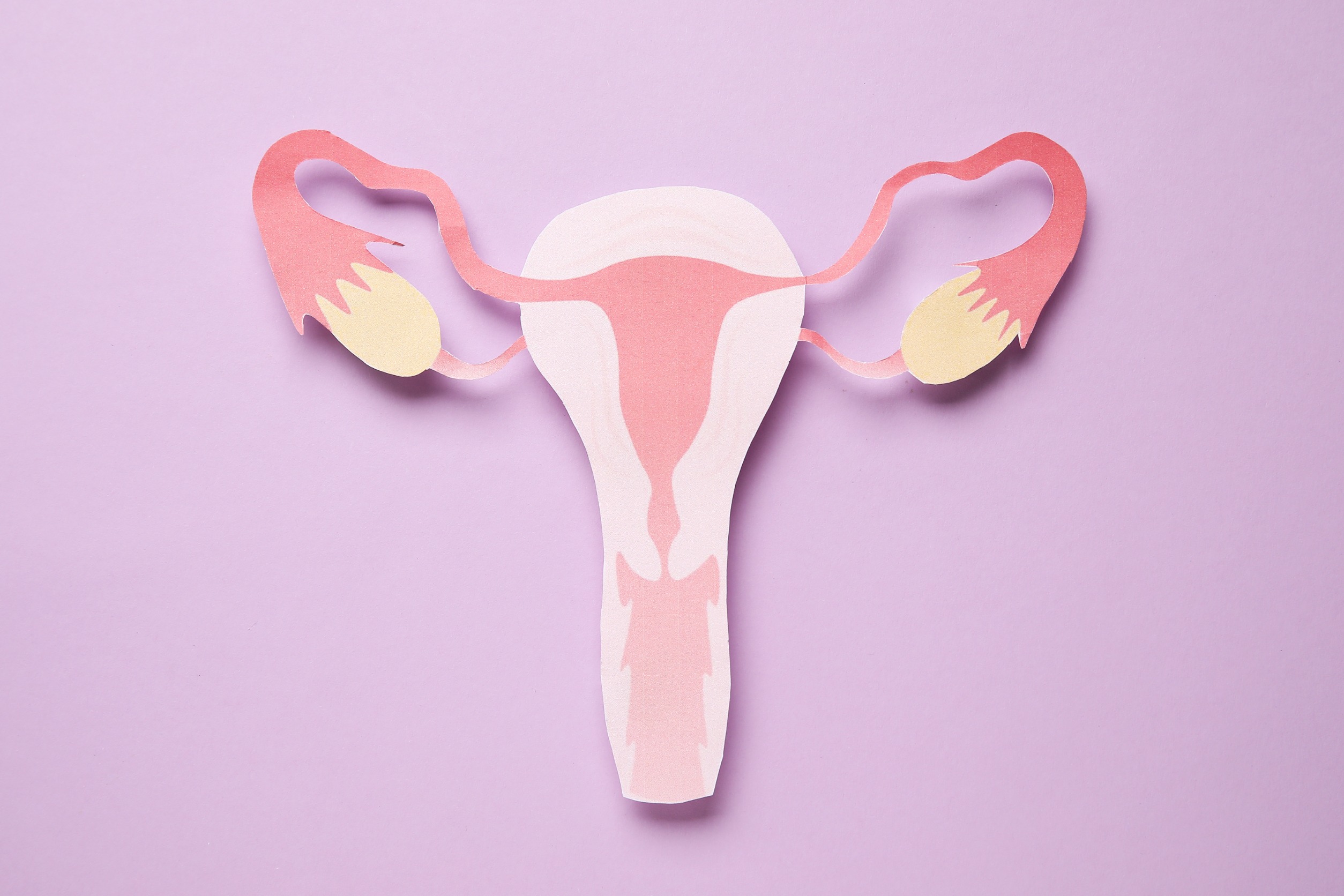
Endometrium jest złożoną tkanką, która wyściela jamę macicy. W sposób ciągły reaguje na zmiany hormonalne w organizmie. Endometrioza ujawnia się w postaci tkanki endometriotycznej w jamie otrzewnej. Zazwyczaj lokalizuje się ją na zewnętrznych ścianach macicy i jajnikach. [1]
Choroba ta w szczególności objawia się przewlekłym bólem miednicy, bolesnym miesiączkowaniem z obfitym krwawieniem miesiączkowym, a także niepłodnością. Amerykańskie Towarzystwo Medycyny Rozrodu dzieli endometriozę na cztery stadia (minimal, mild, moderate, severe – minimalny, łagodny, umiarkowany, ciężki). [1]
Zasięg działania mikrobioty w organizmie
Mikrobiotę każdego człowieka zalicza się do trzech enterotypów: Bacteroides, Prevotella lub Ruminococcus. Zróżnicowane są pod względem składu, funkcji oraz odpowiedzi na składniki dietetyczne. Każdy odcinek przewodu pokarmowego jest zasiedlony przez różne bakterie pod względem rodzaju i liczebności. W jelicie grubym znajduje się 70% całej masy mikroorganizmów. [7]
Znaczenie mikrobioty jelitowej jest uzależnione od prowadzonego przez bakterie metabolizmu. Funkcje grup bakterii często się wzajemnie dopełniają. A rola mikrobioty jelit wykazuje szeroki fizjologiczny zakres. Bakterie Bifidobacterium ssp., Bacterioides ssp. i Lactobacillus spp mają zdolność kodowania zróżnicowanych enzymów, które rozkładają złożone węglowodany, białka oraz lipidy. [6]
Rola mikrobioty w zdrowieniu i stanach chorobowych
W jelicie człowieka bytuje około 1012–1014 bakterii. W obrębie mikrobioty jelitowej można wyróżnić bakterie Gram-dodatnie, jak i Gram-ujemne bezwzględnie oraz względnie beztlenowe. Mikrobiota utrzymuje homeostazę układu immunologicznego i zapobiega namnażaniu się bakterii chorobotwórczych (Salmonella spp., Shigella spp., Staphylococcus aureus). [5]
Zaburzenia w strukturze ilości i jakości mikrobioty jelitowej wprowadza nieprawidłowości w funkcjonowaniu układu pokarmowego. W dalszej konsekwencji może prowadzić to do rozwoju zaburzeń metabolicznych oraz chorób autoimmunizacyjnych. Odnotowano również powiązanie zaburzeń mikrobioty jelit z ujawnianiem się chorób cywilizacyjnych, wśród których można wymienić cukrzycę typu 2, otyłość, a także nadciśnienie. [6]
Zmienność mikrobiomu pod wpływem hormonów
Mikrobiom jelitowy ulega zmianie pod wpływem hormonów. Skład mikrobiomu jelitowego zmienia się przed i po okresie dojrzewania. Niektóre bakterie jelitowe syntetyzują enzymy beta-glukuronidazy,które uwalniają (dekoniugują) różne cząsteczki np. grupy cukrowej do wchłaniania w krążeniu jelitowo-wątrobowym. W wyniku tego procesu wytwarza się energia dla bakterii jelitowych. Hormony płciowe mogą bezpośrednio wpływać na skład mikrobiomu jelitowego, zmieniając aktywność beta-glukuronidazy. Hormony te również modulują mikrobiom jelitowy, wpływając na receptory estrogenowe w komórkach nabłonka jelit. Zmiany poziomu estrogenów regulują sygnalizację receptorów steroidowych w układzie żołądkowo-jelitowym. Modyfikacjom podlegają funkcje jelit, takie jak kurczliwość, pasaż lub wydzielanie hormonów jelitowych. [11]
Mikrobiota żeńskiego układu rozrodczego
W układzie płciowym kobiet zlokalizowane jest 37 rodzajów bakterii. Najliczniej występują pałeczki kwasu mlekowego z rodzaju Lactobacillus. Bakterie tego rodzaju hydrolizują glikogen oraz polisacharydy. Pozwala to na przemianę do kwasu mlekowego. Dochodzi także do obniżenia pH (poniżej 4,5), co przeciwdziała kolonizacji przez bakterie chorobotwórcze. Lactobacillus wydzielają bakteriocyny, które działają bakteriostatycznie i bakteriobójczo. Struktura i liczebność bakterii w środowisku układu rozrodczego zależna jest od czynników genetycznych, środowiskowych, poziomu hormonów, a także ujawnienia predyspozycji indywidualnych do kolonizacji. [8]
Mikrobiota wykazuje zmienny profil od pochwy do zatoki Douglasa. Górny odcinek układu rozrodczego jest zasiedlony w większej ilości i bardziej różnorodnie. Skład mikrobioty różni się w fazach cyklu miesięcznego, w zależności od wieku oraz w wyniku stosowanej antykoncepcji. Mikrobiota endometrium ma określony, nietypowy skład: Lactobacillus (30,6%), Pseudomonas (9,09%) Acinectobacter (9,07%), Vagococcus (7,29%) oraz Sphingobium (5,0%). Dotychczas nie ustalono normy na fizjologiczny stan mikrobioty dróg rodnych. Za nieprawidłowy uznaje się ten, który prowadzi do stanu zapalnego i niepożądanych objawów klinicznych. [9]
Przegląd badań wskazujących na związek mikrobioty z endometriozą
1
W jelitach kobiet cierpiących na endometriozę stwierdzono większą obecność bakterii następujących szczepów Actinobacteria, Firmicutes, Proteobacteria i Verrucomicrobia niż u kobiet w grupie kontrolnej. Jednocześnie populacja Lactobacillaceae utrzymywała się w zmniejszonej liczebności. Mikrobiom chorych na endometriozę jest szczególnie zasobny w Proteobacteria, Enterobacteriaceae, Streptococcus i E. coli. W środowisku jelit pacjentek zlokalizowane są także większe grupy szczepów Corynebacterium, Flavobacterium oraz Pseudomonas. Wśród kobiet z zakresem objawów w zaawansowanym stadium (w tym silny ból, niepłodność) wykryto zmniejszone bogactwo i różnorodność mikrobiomu szyjki macicy. Spekuluje się, iż mikrobiom szyjki macicy może mieć swój udział w regulacji patogenezy powikłań endometriozy. [12]
Różnice obserwuje się także w obrębie mikrobiomu otrzewnowego. W płynie otrzewnowym pacjentek z endometriozą w większej ilości występują szczepy takie jak Acidovorax, Devosia, Methylobacterium, Phascolarctobacterium i Streptococcus w porównaniu do uczestniczek z grupy kontrolnej. [12]
2
Poddano badaniu 14 pacjentek z rozpoznaną endometriozą w stadium III-IV zgodnie z klasyfikacją American Fertility Society. Stwierdzono różnice w składzie mikrobiomu w odniesieniu do grupy kobiet zdrowych. U chorych kobiet Gardnerella stanowiła istotnie większy odsetek pozostałej mikroflory w szyjce macicy niż w grupie kontrolnej (67,7% względem 36,8%). Udział tego szczepu stanowił 10,5% wszystkich bakterii. Zaobserwowano również zwiększoną obecność Streptococcus, Escherichia, Shigella i Ureaplasma. Dawki Prevotella i Dialister były zmniejszone u pacjentek z endometriozą w porównaniu ze zdrowymi kobietami. W próbkach pacjentek określono brak konkretnego rodzaju Atopobium. [13]
3
Zaistnienie przewagi oportunistycznych bakterii patogennych w mikrobiocie dróg rodnych przy jednoczesnej zmniejszonej liczebności Lactobacillus sprzyja pojawieniu się stanu zapalnego. Zaangażowane są wówczas następujące bakterie Gardnerella, Prevotella i Bacteroides. W warunkach kolonizacji tymi rodzajami bakterii i predyspozycji do utrzymania się zapalenia zwiększa się ryzyko wystąpienia endometriozy. [14]
4
Zbadano skład mikrobioty u myszy, którym wstrzyknięto dootrzewnowo tkankę endometrialną. Po upływie 42 dni rozwinęła się wyraźna mikrobiota z sześcioma cechami różnicującymi. Pomiaru dokonano na poziomach taksonów. W kategorii typu Firmicutes i Actinobacteria występowały licznie w grupie z endometriozą. Na poziomie klasy u chorych myszy odnotowano dużą liczbę niezidentyfikowanych promieniowców i betaproteobakterii. W obrębie rodzin bakterii utrzymana została duża grupa Bifidobacteriaceae. Natomiast zgodnie z rodzajem wyróżniono trzy: Ruminococcaceae -UGG-014, Bifidobacterium i Parasutterella. Interpretacja liczebności Firmicutes do Bacteroidetes powszechnie uznawana jest za oznakę dysbiozy. U myszy z endometriozą był prawie dwukrotnie wyższy niż u myszy w grupie kontrolnej. [15]
Możliwe mechanizmy wpływu mikrobioty na rozwój i progresję endometriozy
Odpowiedź estrogenowa
Znany jest wpływ mikrobiomu na środowisko estrogenowe. W przypadku dysbiozy ujawniają się tak zwane estrobolomy, które wytwarzają aktywne enzymy. β-glukuronidaza i β-glukozydaza zmieniają metabolizm estrogenów, co prowadzi do zwiększonego wchłaniania wolnych estrogenów w jelitach. Utrzymuje się wówczas stan hiperestrogenny, który stanowi stymulant progresji endometriozy. [12]
Przeprowadzono badanie wśród 16 kobiet chorych na endometriozę, z porównaniem do kobiet zdrowych w grupie kontrolnej. Kobiety otrzymały leczenie agonistą hormonu uwalniającego gonadotropinę (GnRHa), który znosił działanie estrogenów. Przeanalizowano skład kolonii drobnoustrojów w wymazach z endometrium i płynie torbielowatym. Przy niskich zasobach estrogenów odsetek szczepu Lactobacillaceae był znacząco zmniejszony, a szczepy Streptococcaceae, Staphylococcaceae, Enterobacteriaceae występowały na zwiększonym poziomie. Natomiast wysoka dostępność estrogenów sprzyjała dominacji Lactobacillus. Badanie wskazuje, iż estrogeny modulują jakościową i ilościową kolonizację środowiska wewnątrzmacicznego oraz płynu torbielowatego. [16]
Czynniki genetyczne i epigenetyczne
Bakterie oraz wirusy mogą stanowić czynniki wywołujące zjawiska o podłożu genetycznym, oraz epigenetycznym w komórkach endometrium. Zwiększona ilość wydzielanych endotoksyn przyczynia się do rozwoju stresu oksydacyjnego i zmian w funkcjonowaniu układu immunologicznego. Stymulacja tego układu prowadzi do łagodnego zapalenia jamy otrzewnej u kobiet chorych na endometriozę. Może stać się współistniejącym czynnikiem wzrostu zmian endometriozy. [17]
Dwukierunkowe działanie mikrobioty w endometriozie
Endometrioza jako podłoże zmian w mikrobiocie
Sugeruje się, iż istnieje korelacja rozwoju zmienionego mikrobiomu po ujawnieniu się endometriozy. W badaniu z udziałem myszy chorych na endometriozę stwierdzono, iż mikrobiota jelitowa przekształciła się w kierunku wzrostowym dla bakterii Firmicutes i Bacteroidetes. [18]
Mikrobiota jako czynnik wyzwalający endometriozę
W 2021 roku wysunięto hipotezę, iż to określona mikrobiota może generować pojawienie się endometriozy. Zaburzona równowaga mikrobioty (dysbioza) istotnie wpływa na zmianę w odpowiedzi immunologicznej. Dochodzi do podwyższenia poziomu cytokin prozapalnych i profile komórek odpornościowych ulegają zmianie. Rozpoczyna się proces stanu zapalnego, który sprzyja rozwojowi endometriozy. Przewlekły stan zapalny związany z endometriozą przyczynia się do powstawania zrostów, które prowadzą do upośledzenia czynnościowego i rozwoju nowych naczyń krwionośnych (angiogeneza). [19]
Hipoteza przewlekłego bólu miednicy
Zbadano grupę kobiet z zespołem przewlekłego bólu miednicy. Średni czas trwania objawów wynosił 48 miesięcy. Wykazano znacznie mniejszą różnorodność mikrobiomu jelitowego oraz znacznie niższą liczbę bakterii Prevotella. [20]
W analizach doszukano się powiązania wpływu zmian w mikrobiocie na ból w obszarze miednicy. Mikrobiota jelitowa i powiązane metabolity odgrywają ważną rolę w rozwoju oraz dojrzewaniu mikrogleju. Mikrobiom jelit może regulować funkcje mikrogleju. Interakcje na linii mikrobiom-mikroglej mają związek z utrzymywaniem się przewlekłego bólu. Jednym z mechanizmów, na który się wskazuje, jest przeciek drobnoustrojów jelitowych w zaburzonej barierze jelitowej. Punktem centralnym okazał się enzym — hydrolaza acyloksyacylowa (AOAH). U myszy z niedoborem AOAH stwierdzono dysbiozę jelitową. Zaburzenie wśród mikroorganizmów w jelicie oddziałuje na mikroglej. Zaobserwowano aktywację mikrogleju w regionach mózgu ważnych dla modulacji bólu. [21]
Spożycie probiotyków w regulacji mikrobioty
Mikrobiota jelit kształtuje się i rozwija pod wpływem określonych składników poddawanych trawieniu bakterii. Do produktów, które najbardziej promują populację szczepów, można zaliczyć te zasobne w błonnik. Należą do nich suche nasiona roślin strączkowych, większość owoców i warzyw oraz pełnoziarniste produkty zbożowe. Najwięcej błonnika zawierają otręby pszenne. Źródłem stymulującym mikrobiotę są naturalnie występujące probiotyki w postaci głównych szczepów Lactobacillus i Bifidobacterium. Można je znaleźć w fermentowanych produktach mlecznych, takich jak jogurt, kefir, a także mleko acidofilne. Efekt fizjologiczny uzależniony jest od dawki dobowej. Za najbardziej skuteczną ilość w tworzeniu kolonii uznaje się 106-109 szczepów bakteryjnych, które są w stanie przeżyć. Osiągnięcie tej wartości możliwe jest, dzięki regularnemu spożyciu produktów probiotycznych w ilości 300-400 g/tydzień. [22]
Dieta w łagodzeniu objawów endometriozy
Dieta śródziemnomorska wykazuje potencjał w walce z bólem u pacjentek z endometriozą. Takie wnioski wysunięto po badaniu z udziałem 68 kobiet. Kobiety wprowadziły plan żywieniowy oparty na wspomnianej diecie, w której uwzględniono między innymi świeże owoce i warzywa, białe mięso, ryby, pełnoziarniste pieczywo, żywność bogatą w magnez i oleje tłoczone na zimno. Wyeliminowano z jadłospisu słodkie napoje, czerwone mięso, słodycze i tłuszcze zwierzęce. Stopień bólu określono w Numerycznej Skali Oceny (NRS). Finalnie stwierdzono znaczne złagodzenie bólu ogólnego, bolesnego miesiączkowania oraz poprawę stanu ogólnego. [23]
W badaniu na terenie Meksyku wykazano, iż kobiety chore na endometriozę spożywały o 30% mniej witaminy C i o 40% mniej witaminy E w porównaniu do kobiet zdrowych. Po 3-miesięcznym stosowaniu diety bogatej w przeciwutleniacze u kobiet chorych na endometriozę stwierdzono wyższe obwodowe stężenia witamin. W następnym randomizowanym badaniu kontrolnym stężenie powyższych witamin wpłynęły na złagodzenie objawów endometriozy. [24]
Dieta jako element wspierający stan fizjologiczny pacjentek
Dieta w endometriozie ma znaczenie zarówno wzmacniające, jak i uzupełniające niedobory. Często pacjentki borykają się z deficytami magnezu, żelaza, witamin z grupy B (zwłaszcza B6 i B12), cynku, selenu i kwasu foliowego. Bardzo istotne jest zadbanie o dostarczenie niezbędnych witamin i składników mineralnych w zakresie obniżającym stan zapalny i wzmacniającym odporność. [4]
Obniżona przyswajalność żelaza w endometriozie
W przebiegu endometriozy mogą pojawić się problemy z przyswajaniem żelaza. Dotychczas powstały badania, w których odkryto wspierające działanie L. plantarum 299v. Zażywanie żelaza sukrosomalnego wraz z witaminą C oraz wspomnianego szczepu zwiększało wchłanialność pierwiastka. W innym badaniu ujawniono zdolność szczepu Lactobacillus acidophilus do zwiększania wytwarzania ferrytyny w komórkach jelitowych u osób z niedokrwistością z niedoboru żelaza. [25]
Szczepy Lactobacillus
We wsparciu terapii endometriozy można uwzględnić zastosowanie określonych szczepów probiotycznych. Zasadność ich wykorzystania została przedstawiona w badaniach z udziałem pacjentek w 3. i 4. stadium endometriozy. Kobiety przyjmowały 1 kapsułkę dziennie zawierającą 109 kolonii czterech różnych szczepów Lactobacillus (Lactobacillus acidophilus, Lactobacillus plantarum, Lactobacillus fermentum i Lactobacillus gasseri). Suplementacja trwała 8 tygodni. Za pomocą skali wizualno-analogowej (VAS) zaobserwowano korzystny wpływ szczepów Lactobacillus na ból związany z endometriozą, w szczególności bolesne miesiączkowanie i przewlekły ból miednicy. [26]
W innym badaniu oceniono wpływ Lactobacillus acidophilus na komórki krwi u kobiet chorych na endometriozę. Suplementacja tym szczepem modulowała poziom prozapalnych interleukin IL-1 i IL-6. Jest to potencjalna korzyść terapeutyczna. [27]
Udział mikrobioty w procesach metabolicznych
Mikrobiota ma swoje znaczenie w rozwoju zaburzeń metabolicznych. W organizmach myszy chorych na cukrzycę typu 2 odkryto nieprawidłowy skład bakterii. Dopiero po podaniu antybiotyków parametry w surowicy krwi (glikemia na czczo, insulinowrażliwość) uległy poprawie. Rozwój insulinooporności oraz cukrzycy może być stymulowany przez metaboliczną endotoksemię w zakresie mikrobioty. Odbywa się to w schemacie powstawania stanu zapalnego. Początek stanowi dysbioza wywołana brakiem integralności nabłonka jelit. Wzmaga się przepuszczalność dla tak zwanego lipopolisacharydu, który jest prozapalny i wchodzi w skład komórek bakterii. Taki profil mikrobioty zwiększa ryzyko insulinooporności, cukrzycy oraz otyłości. [10]
Mikrobiota a procesy immunologiczne
Ponadto mikrobiota immunostymuluje komórki tkanki limfatycznej (gut-associated lymphoid tissue — GALT). Są one elementem składowym układu odpornościowego błon śluzowych (mucosa-associated lymphoid tissue — MALT). Bakterie mikrobiomu wprowadzają w gotowość komórki odpornościowe. Należą do nich Enterococcus, które aktywują komórki układu immunologicznego w jelitowym nabłonku do syntezy immunoglobulin IgA (sIgA). IgA biorą udział w nieswoistej odporności śluzówkowej. Immunoglobulina odpowiada za hamowanie zakotwiczania patogennych komórek bakterii, wirusów i grzybów do nabłonka błon śluzowych. Wykazuje także działanie bakteriostatycznie i neutralizuje toksyny bakteryjne. [6]
Epidemiologia endometriozy
Endometrioza dotyka około 10–15% kobiet w wieku rozrodczym. Szacuje się, że 35–50% kobiet zmaga się z bólami miednicy oraz niepłodnością. Szczyt zachorowań obserwuje się pomiędzy 25. a 45. rokiem życia. Choroba ta może ujawnić się w okresie menopauzy, a także u dorastających dziewcząt. W analizach wykazano, iż czynnik genetyczny odpowiada za około 50% predyspozycji do zachorowania na endometriozę. Symptomy choroby mogą zostać wywołane czynnikami środowiskowymi. Jednak uwarunkowania genetyczne sprzyjają przejściu początkowych zmian w stadium choroby. Niektóre układy polimorfizmu pojedynczego nukleotydu (SNP) powiązane są z rozwojem endometriozy. [2]
Aktualne podejście do leczenia endometriozy
W przypadku, gdy endometrioza występuje na niskim poziomie, ale zmiany wywołują ból, zaleca się operację chirurgiczną. Jest to działanie zapobiegawcze wobec rozwoju choroby. Torbiele endometrialne na jajnikach także się usuwa, przy tym częstość nawrotów zmniejsza się do 20%. Bardziej zaawansowane operacje zarezerwowane są dla głębokich zmian endometriozy. Zazwyczaj dotyczą zmian w obrębie jelit i resekcji tego narządu. Zabieg może obejmować także okoliczne tkanki, aby nie dopuścić do rozrostu endometriozy. [3]
W obrębie leczenia hormonalnego stosuje się złożone doustne środki antykoncepcyjne, progestageny, antyprogestageny, agonistów hormonu uwalniającego gonadotropinę oraz antagonistów, a także inhibitory aromatazy. Jednak praktyka w przepisywaniu jest zróżnicowana. [3]
Pod wpływem leków następuje zmniejszenie krwawienia miesiączkowego, a to obniża wyzwalanie szlaków zapalnych generujących ból. [3]
Wpływ endometriozy na jakość życia kobiet
Przewlekły ból, którym objawia się endometrioza, rzutuje na codzienne funkcjonowanie kobiet. Pacjentki przeżywają trudny stan. Często kobiety muszą rezygnować ze swoich planów i podporządkowywać się chorobie. Spotyka się to z niezrozumieniem otoczenia. Niekiedy w okresach wzmożenia objawów ich produktywność zawodowa ulega pogorszenia. Odpowiednio dobrana dieta i niekiedy zmiana stylu życia może przynieść ulgę, a także zmienić jakość codzienności.
Podsumowanie
Wiedza o związku mikrobioty z endometriozą wykazuje potencjał do wykorzystania w polepszeniu stanu fizjologicznego chorych kobiet. Zażywanie probiotyków bądź włączenie żywności probiotycznej w odpowiedniej ilości do codziennej diety aktywuje układ odpornościowy. Jest to bardzo istotne w obliczu osłabienia organizmu chorobą generującą przewlekłe zapalenie. Szczepy Lactobacillus mogą znosić objawy bólowe pacjentek. Ponadto L. plantarum 299v poprawia przyswajalność żelaza, gdy organizm jest narażony na jego nadmierną utratę. Warto w opracowywaniu diety przy endometriozie dopełniać ją dopasowaną dawką probiotyków. Każdy krok w kierunku odebrania chorobie siły jest bezcenny.
Bibliografia:
- Pašalić E, Tambuwala MM, Hromić-Jahjefendić A: Endometriosis: Classification, pathophysiology, and treatment options. Pathology – Research and Practice, 2023, 251 (1-7).
- Smolarz B, Szyłło K, Romanowicz H: Endometriosis: Epidemiology, Classification, Pathogenesis, Treatment and Genetics (Review of Literature). International Journal of Molecular Science, 2021, 22, 1-29.
- Koninckx PR, Fernandes R, Ussia A, Schindler L, Wattiez A, Al-Suwaidi S, Amro B, Al-Maamari B, Hakim Z, Tahlak M: Pathogenesis Based Diagnosis and Treatment of Endometriosis. Frontiers in Endocrinology, 2021, 12, 1-13.
- Abramiuk M, Mertowska P, Frankowska K, Świechowska-Starek P, Satora M, Polak G, Dymanowska-Dyjak I, Grywalska E: How Can Selected Dietary Ingredients Influence the Development and Progression of Endometriosis? Nutrients, 2024, 16, 154.
- Malinowska M, Tokarz-Deptuła B, Deptuła W: Mikrobiom człowieka. Postępy mikrobiologii, 2017, 56, 1, 33–42.
- Gałęcka M, Basińska A, Bartnicka A: Znaczenie mikrobioty jelitowej w kształtowaniu zdrowia człowieka — implikacje w praktyce lekarza rodzinnego. Forum Medycyny Rodzinnej, 2018, 12, 2, 50–59.
- Skrzydło-Radomańska B, Wronecki J: Czy mikrobiotę jelitową można skutecznie modyfikować? Varia Medica, 2019, 3(1), 18-26.
- Pytka M, Kordowska-Wiater M, Jarocki P: Microbiome of the women’s genital system. Advancements of microbiology, 2019, 58, 3, 227–236.
- Macura B, Majewska-Szczepanik M, Strzępa A, Szczepanik M: Wpływ mikrobioty macicy na zdrowie kobiety i jej potomstwa. Medycyna ogólna i nauki o zdrowiu, 2020, 26, 3, 230–239.
- Ostrowska L: Wpływ mikrobioty jelitowej na zaburzenia metaboliczne i otyłość — punkt widzenia internisty i dietetyka, Gastroenterologia Kliniczna, 2016, 8, 2.
- Thackray V: Sex, Microbes, and Polycystic Ovary Syndrome. Trends in Endocrinology & Metabolism, 2019, 30, (1), 54–65.
- Uzuner C, Mak J, El-Assaad F, Condous G: The bidirectional relationship between endometriosis and microbiome. Frontiers in Endocrinology, 2023, 1-8.
- Baris A, Yildiz S, Turkgeldi E, Pérez Brocal V, Dinleyici C, Moya A, Urman B: The endobiota study: comparison of vaginal, cervical and gut microbiota between women with stage 3/4 endometriosis and healthy controls. Scientific Reports, 2019, 9:2204.
- Jiang J, Yong P, Allaire C, Bedaiwy M: Intricate Connections between the Microbiota and Endometriosis. International Journal of Molecular Sciences, 2021, 26; 22 (11), 5644.
- Yuan M, Li D, Zhang Z, Sun H, An M, Wang G: Endometriosis induces gut microbiota alterations in mice. Human Reproduction, 2018, 33, 4, 607–616.
- Khan K, Fujishita A, Masumoto H, Muto H, Kitajima M, Masuzaki H, Kitawaki J: Molecular detection of intrauterine microbial colonization in women with endometriosis. European Journal of Obstetrics and Gynecology, 2016, 199, 69-75.
- Koninckx PR, Ussia A, Tahlak M, Adamyan L, Wattiez A, Martin DC, Gomel V: Infection as a potential cofactor in the genetic-epigenetic pathophysiology of endometriosis: a systematic review. Facts, views & vision in ObGyn, 2019, 11(3), 209–216.
- Zizolfi B, Foreste V, Gallo A, Martone S, Giampaolino, Di Spiezio Sardo A: Endometriosis and dysbiosis: State of art. Frontiers in Endocrinology, 2023, 20, 14, 1140774.
- Xholli A, Cremonini F, Perugi I, Londero A, Cagnacci A, Gozzelino R: Gut Microbiota and Endometriosis: Exploring the Relationship and Therapeutic Implications. Pharmaceuticals (Basel), 2023, 16(12), 1696.
- Shoskes D, Wang H, Polackwich A, Tucky B, Altemus J, Eng Ch: Analysis of Gut Microbiome Reveals Significant Differences between Men with Chronic Prostatitis/Chronic Pelvic Pain Syndrome and Controls. Journal of Urology, 2016, 196(2), 435-41.
- Rahman-Enyart A, Yaggie R, Bollinger J, Arvanitis C, Winter D, Schaeffer A, Klumpp D: Acyloxyacyl hydrolase regulates microglia-mediated pelvic pain. Plos One, 2022, 18, 17(8).
- Jeziorek M, Regulska-Ilow B: Składniki diety i ksenobiotyki a skład mikrobioty jelitowej. Hygeia Public Health, 2019, 54(3), 131-143.
- Nirgianakis K, Egger K, Kalaitzopoulos D, Lanz S, Bally L, Mueller M: Effectiveness of Dietary Interventions in the Treatment of Endometriosis: a Systematic Review. Reproductive Sciences, 2022, 29(1), 26-42.
- Barnard N, Holtz D, Schmidt N, Kolipaka S, Hata E, Sutton M, Znayenko-Miller T, Hazen N, Cobb C, Kahleova H: Nutrition in the prevention and treatment of endometriosis: A review. Frontiers in Nutrition, 2023, 17, 10.
- Rusu IG, Suharoschi R, Vodnar D, Pop CR, Socaci SA, Vulturar R, Istrati M, Moroșan I, Fărcaș A, Kerezsi AD, Mureșan CI, Pop OL: Iron Supplementation Influence on the Gut Microbiota and Probiotic Intake Effect in Iron Deficiency—A Literature-Based Review. Nutrients, 2020, 12, 1993.
- Khodaverdi S, Mohammadbeigi R, Khaledi M, Mesdaghinia L, Sharifzadeh F, Nasiripour S, Gorginzadeh M: Beneficial effects of oral Lactobacillus on pain severity in women suffering from endometriosis: a pilot placebo-controlled randomized clinical trial international. Journal of fertility and sterility, 2019, 178-183.
- Sari FM, Mirkalantari S, Nikoo S, Sepahvand F, Allahqoli L, Asadi A, Talebi M: Potential of Lactobacillus acidophilus to modulate cytokine production by peripheral blood monocytes in patients with endometriosis. Iranian Journal of Microbiology, 2022, 14(5), 698–704.
- Perrotta A, Borrelli GM, Martins CO, Kallas EG, Sanabani S, Griffith L, Alm EJ, Abrao M: The Vaginal Microbiome as a Tool to Predict rASRM Stage of Disease in Endometriosis: a Pilot Study. Reproductive Sciences, 2020, 27(4), 1064–1073.
- Jiang I, Yong P, Allaire C, Bedaiwy M, Donnez J: Intricate Connections between the Microbiota and Endometriosis. International Journal of Molecular Sciences, 2021, 22(11), 5644.