Antyoksydanty nazywane są inaczej przeciwutleniaczami lub antyutleniaczami. Są to substancje, które swym zasięgiem obejmują wiele grup związków chemicznych. Najczęściej są one kojarzone z działaniem antykancerogennym. Trudno jednak o szybką i prostą analizę. Oprócz naturalnie występujących związków istnieją także syntetyczne. Ich rolą jest ochrona spożywanej przez nas żywności. Chronią przed niekorzystnymi zmianami spowodowanymi utlenianiem i przedłużają trwałość produktów spożywczych. Wszystko po kolei.
Czego dowiesz się z tego artykułu?
Chcąc dobrze zrozumieć temat antyoksydantów i ich wpływu na nasz organizm, poświęć chwilę na przeczytanie artykułu. Dowiesz się z niego, czym są wolne rodniki, stres oksydacyjny, czy reaktywne formy tlenu. Dlaczego mówi się o nich przy okazji przeciwutleniaczy? W artykule przedstawiony został mini przewodnik. Znajdziesz w nim informacje na temat poszczególnych antyoksydantów i ich roli w naszym organizmie. Czy dostarczanie antyoksydantów pomoże zredukować ryzyko chorób? Sprawdźmy to razem.
Artykuł podpowie, czy antyoksydanty dostarczamy tylko z zewnątrz, czy może w naszym organizmie występują one naturalne. Poznasz prawdziwych mocarzy wśród antyutleniaczy, a więc najpotężniejsze z nich. Znajdziesz podpowiedzi gdzie ich szukać. Przeanalizujemy razem skalę ORAC i nie tylko. W artykule odnajdziesz wskazówki, które pomogą dzięki prostym modyfikacjom osiągnąć wielkie rezultaty. Mowa tu o większej ilości antyoksydantów w diecie dzięki prostym nawykom.
Antyoksydanty codziennie walczą o Twoje zdrowie. Nie bądź obojętny. Przeczytaj o swoich bohaterach.
Spis treści:
- Zacznijmy od początku. Co to są wolne rodniki, stres oksydacyjny, reaktywne formy tlenu?
- Czym są antyoksydanty.
- Podział antyoksydantów.
- Rola antyoksydantów w życiu człowieka.
- Na redukcję rozwoju, jakich chorób mają wpływ antyoksydanty?
- Prezentacja bohaterów, czyli słów kilka o poszczególnych naturalnych przeciwutleniaczach.
- Antyoksydanty w żywności.
- Owoce jagodowe. Polskie superfoods jako źródło antyoksydantów.
- Czy właściwości antyoksydacyjne zmniejszają pod wpływem procesów technologicznych i temperatury?
- Małe zmiany a duże korzyści. Jak stosując kilka zasad zwiększyć ilość antyoksydantów w diecie?
- Jak rozpoznać produkt zawierający duże ilości antyoksydantów? Skala ORAC i nie tylko.
- Czy istnieje ilość dostarczanych z żywnością antyoksydantów, którą można określić jako bezpieczną?
- Najpotężniejsze przeciwutleniacze na świecie.
- Antyoksydanty w kosmetykach.
- Podsumowanie i wnioski.
Co to są wolne rodniki, stres oksydacyjny, reaktywne formy tlenu?
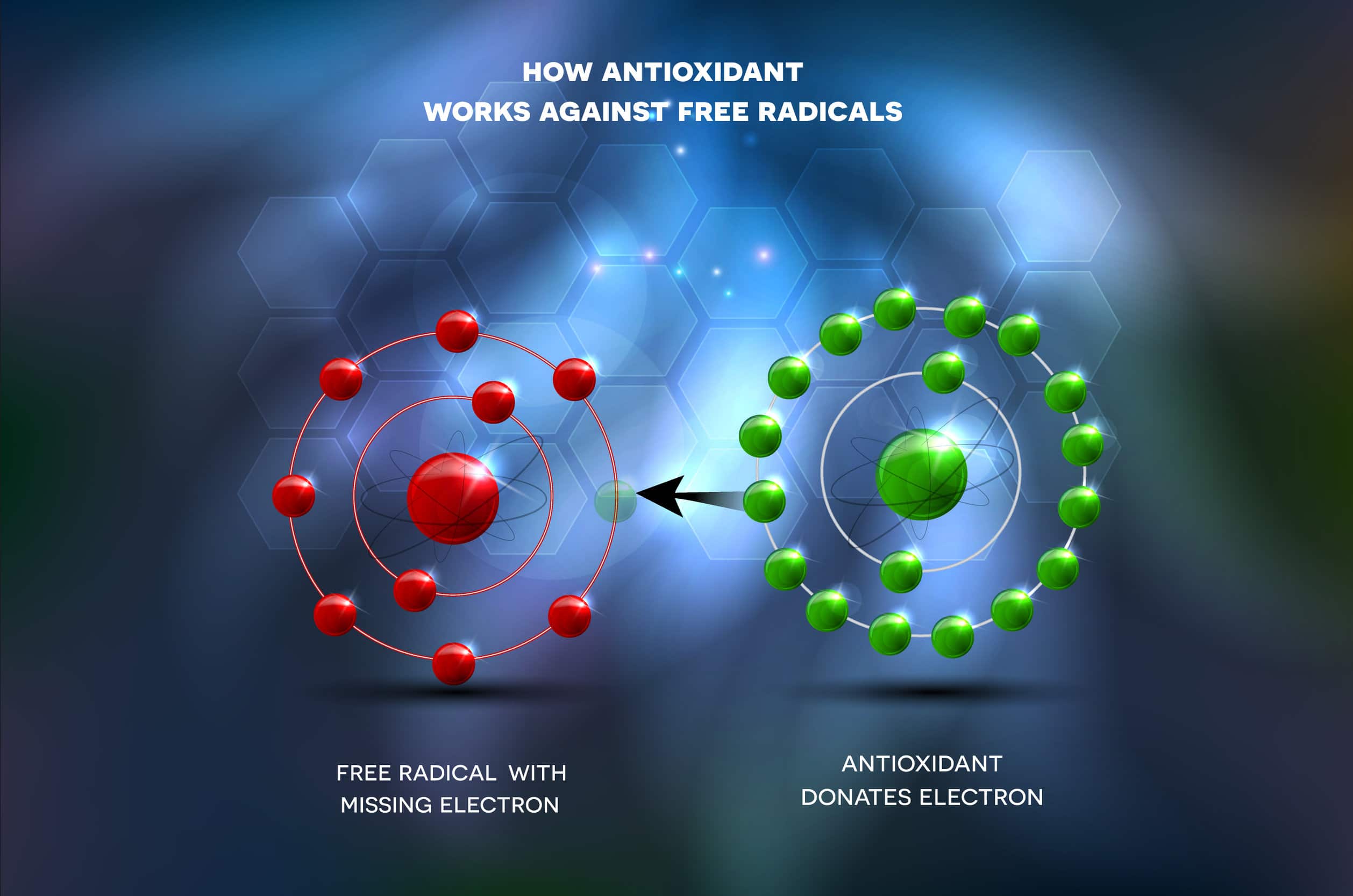
Wolne rodniki to obok nadtlenku wodoru i tlenu singletowego, reaktywne formy tlenu. Wolny rodnik to atom lub cząsteczka zdolna do samodzielnego istnienia. Ma ona jeden lub więcej niesparowanych elektronów na orbicie walencyjnej. Brzmi dość chemicznie. Najważniejsze jest jednak, co to dla nas oznacza. Ze względu na brak przynajmniej jednego elektronu, wolne rodniki są reaktywne. Nie podoba im się sytuacja braku czegoś. Dążą do tego, by to uzyskać (mowa o tym brakującym elektronie). Dość przykro o tym mówić, ale wolne rodniki można porównać do złodziei. Oddziałują one na struktury komórkowe, takie jak membrana, kwas dezoksyrybonukleinowy (DNA), białko i lipidy. „Kradną” ich elektrony, co zaburza składowe komórki.
Powstają one w naszym organizmie, jak i pochodzą z zewnątrz. Ich powstawanie obejmuje reakcje enzymatyczne uczestniczące w łańcuchu oddechowym, fagocytozie, syntezie prostaglandyn oraz w układzie cytochromu P-450. W momencie, gdy dochodzi do infekcji, czy stanów zapalnych powstają wolne rodniki. Dzieje się podobnie, jeśli nadmiernie obciążasz swój organizm treningami, stresujesz się. Na starzenie się nie masz wpływu. Ono także wzmaga produkcję wolnych rodników.
Inną przyczyną może być nowotwór. Do źródeł egzogennych (zewnętrznych), zaliczamy: dym tytoniowy, promieniowanie, zanieczyszczenie środowiska, alkohol, metale ciężkie, a nawet leki. Twoja dieta, która będzie bogata w tłuszcze, smażone potrawy to też powód.
Pojawia się pytanie. Czy nasz organizm biernie czeka na swoją samozagładę przez wolne rodniki? A skądże. Tutaj pojawia się rola antyoksydantów. To one ofiarnie oddają swój elektron. Neutralizuje to szkodliwe działanie wolnych rodników. Niestety przeciwutleniacze nie są niezwyciężone. Jak w każdej walce raz wygrywa się bitwę, drugi raz przegrywa. Porażką dla naszego organizmu jest powstanie stresu oksydacyjnego. Jest to sytuacja, w której ze względu na nasz niezdrowy styl życia powstaje nadmiar wolnych rodników. Wówczas złodzieje wolnych elektronów przejmują władzę i niszczą organizm [1], [2], [3].
Zauważ, że opisywany stres oksydacyjny powstaje w wyniku nierównowagi. Warto jednak podkreślić, że reaktywne formy tlenu nie zawsze działają niekorzystnie na nasz organizm. Gdy występują one w stężeniu fizjologicznym, mogą odgrywać rolę w prawidłowym funkcjonowaniu komórek. Dzieje się to poprzez udział w sygnalizacji komórkowej. Wpływają na regulację takich procesów jak: proliferacja, różnicowanie, apoptoza i migracja [4].

Czym są antyoksydanty?
Definicja przeciwutleniaczy pojawiła się w słowniku żywieniowym w latach 90. Wówczas naukowcy zaczęli odkrywać, w jaki sposób reakcje wolnych rodników w organizmie sprzyjają powstawaniu chorób [5].
Aktualnie przeciwutleniaczem jest każda substancja, która wstrzymuje albo opóźnia procesy utleniana. Substancja ta bezpośrednio lub pośrednio działa jako regulator obrony antyoksydacyjnej, lub inhibitor produkcji reaktywnych form [6]. Występują one w stężeniach mniejszych aniżeli substancja podlegająca utlenianiu.
Zgodnie z mechanizmami ich działania możemy je podzielić na:
- Substancje zapobiegawcze, hamujące powstawanie nowych rodników- dysmutaza ponadtlenkowa (SOD), katalaza (CAT), ferrytyna, selen, miedź, cynk
- Substancje wymiatające rodniki, które hamują inicjację lub propagację łańcucha- glutation, albumina, witamina C,E, karotenoidy i flawonoidy
- Enzymy naprawcze i de novo, które naprawiają i odtwarzają błony komórkowe- lipazy, proteazy, enzymy naprawcze DNA, transferazy
- Substancje adaptacyjne, które wytwarzają odpowiednie enzymy antyoksydacyjne i przenoszą je do kluczowych miejsc działania [6,7].
Oczywiście istnieją inne możliwości podziału przeciwutleniaczy. Ten wskazuje również na rolę tych związków w walce o nasz organizm [4].
Podział antyoksydantów
Trudno jest wymienić wszystkie antyoksydanty. Można nawet stwierdzić, że jest to niemożliwe. Ciągle odkrywane są nowe. W dodatku nazwy przeciwutleniaczy wcale nie sprzyjają ich łatwemu zapamiętaniu.
Możemy je jednak podzielić. Wcześniej zapoznaliśmy się z podziałem ze względu na mechanizm działania. Teraz poznamy podział, który ułatwi nam dalszy opis tych związków.
Wyobraź sobie, że rysujemy drzewo genealogiczne. Najczęściej jest ono przedstawione w ten sposób, że nasi najdalsi przodkowie są podstawą. Potem tworzymy „kolejne” gałęzie.
W przypadku antyutleniaczy podstawą jest ich podział na naturalne i syntetyczne.
Zacznijmy od dalszego podziału naturalnych. Wyróżniamy naturalne antyoksydanty egzogenne i endogenne. Te pierwsze musimy dostarczyć „z zewnątrz”, więc z pożywieniem. Te drugie nasz organizm może wytworzyć samodzielnie.
Wśród antyoksydantów egzogennych wyróżniamy: witaminy, składniki mineralne, karotenoidy, polifenole. Endogenne przeciwutleniacze można podzielić jeszcze na enzymatyczne i nieenzymatyczne. Enzymatyczne to enzymy będące podstawowymi systemami obrony oraz będące wtórnym systemem obrony. Nieenzymatyczne to z kolei związki o niskiej masie cząsteczkowej (lipofilne i hydrofilne) i białka wiążące metale. Płynnie przechodząc do antyoksydantów syntetycznych, wymienia się struktury fenolowe i nano- przeciwutleniacze.
Jeśli dotrwałeś do tego momentu, to dalej już będzie tylko prościej. Ciężko jest mówić i opowiadać o czymś, co nie jest znane i trudno to sobie „zaszufladkować”. Dla pewności, że wszystko jasne przeczytaj ten podział wraz z przykładami. To powinno pomóc rozwiać wszystkie wątpliwości.
Tabela 1. Podział antyoksydantów (według własnego opracowania).

Źródło: Flieger J., Flieger W., Baj J., Maciejewski R. (2021). Antioxidants: Classification, Natural Sources, Activity/Capacity Measurements, and Usefulness for the Synthesis of Nanoparticles. MDPI, Materials. 14,4135. https://doi.org/10.3390/ma14154135
Rola antyoksydantów w życiu człowieka
Nadmiar wolnych rodników w naszym organizmie niesie za sobą szereg skutków zdrowotnych. Są one negatywne. Ogólnie rzecz biorąc, szacuje się, że wolne rodniki biorą udział w patogenezie co najmniej 50 chorób! Przeciwutleniacze jak już wiesz, mają za zadanie je neutralizować, bądź spowalniać ich działanie. Nic dziwnego, że korzyści z ich obecności są bardzo rozległe. Trudno wymienić wszystkie, ale będą one wpływać między innymi na:
- Poprawę jakości snu
- Wspomaganie układu oddechowego
- Utrzymanie prawidłowego wzroku
- Zmniejszenie otyłości
- Działanie ochronnie na wątrobę
- Utrzymanie dobrego stanu zębów
- Ochroni przed zaburzeniami trawienia
- Poprawa funkcjonowania układu nerwowego
- Wspomagają układ odpornościowy
- Poprawa rozrodczości
- Wsparcie funkcji nerek
- Działanie przeciwstarzeniowe
- Wpływ na kondycję skóry.
I wiele, wiele innych. Nie umniejszając roli antyoksydantów w życiu człowieka, niektóre z tych funkcji to jedynie przypuszczenie. Inne z kolei w badaniach naukowych nie zawsze są potwierdzane. Pewne jest, że związki te pozytywnie działają na organizm. Nie zawsze ich rola jest jednak kluczowa, czy mająca jakikolwiek wpływ [8,9].

Na redukcję rozwoju, jakich chorób mają wpływ antyoksydanty?
Wolne rodniki mają szerokie pole działania, jeśli chodzi o patogenezę chorób. Nie skupiają się na konkretnym narządzie albo układzie. To prawdziwe szkodniki. Drugą stroną medalu jest to, że nasi bohaterowie potrafią zatrzymać lub spowolnić ich działanie. Przyjrzyjmy się, nawiązując do tego, w patogenezie jakich chorób pojawiają się wolne rodniki.
Mają one wpływ na rozwój chorób naczyń. Wolne rodniki będą powodować uszkodzenie śródbłonka. Prowadzi to z kolei do zmniejszenia aktywności prostacykliny i w efekcie do zaburzeń autoregulacji naczyniowej.
Kolejną chorobą jest miażdżyca. Utlenianie lipoprotein frakcji LDL przyspiesza tworzenie blaszki miażdżycowej. Może to doprowadzić do uszkodzenia śródbłonka oraz nasilić proces peroksydacji lipidowej. Nie są one obojętne również choroby układu oddechowego. U osób z chorobami, takimi jak: przewlekłe zapalenie oskrzeli, astma czy przewlekła obturacyjna choroba płuc, zaobserwowano obniżoną aktywność dysmutazy ponadtlenkowej oraz podwyższoną aktywność oksydazy ksantynowej. Jest to enzym odpowiedzialny za powstawanie rodnika ponadtlenkowego.
Wolne rodniki biorą również udział w rozwoju chorób układu krążenia. Jak wykazano w badaniach, udział wolnych rodników w patogenezie chorób układu krążenia jest istotny. W badaniach potwierdzono wpływ działania wolnych rodników na rozwój choroby niedokrwiennej serca.
Wolne rodniki odpowiadają też za trudność przebycia chorób trzustki. Mogą odgrywać istotną rolę w patogenezie ostrego zapalenia trzustki. Z kolei zaburzenia równowagi układu: utleniacze- przeciwutleniacze, korelują z ciężkością tej choroby. Warto też powiedzieć, że cukrzycy towarzyszy ogólnoustrojowy stres oksydacyjny. Niektóre powikłania cukrzycy jak np. retinopatia cukrzycowa, są prawdopodobnie spowodowane działaniem wolnych rodników.
Inne z chorób to: choroby układu nerwowego (choroba Alzheimera, Parkinsona, stwardnienie rozsiane), zaćma, jaskra. Wśród chorób wymienia się jeszcze choroby skóry, takie jak egzema, łuszczyca.
Nie można też zapominać o rozwoju nowotworów. Wolne rodniki prowadzą do uszkodzenia struktury DNA. Niesie to prawdopodobieństwo wywołania mutacji i predysponuje do powstawania chorób nowotworowych [10].
Jak widzisz, cały mechanizm rozwoju chorób opiera się na nadmiernej ilości wolnych rodników. Wniosek jest jeden: dbajmy o właściwą proporcję utleniaczy- antyutleniaczy. To pozwoli nam cieszyć się dobrym zdrowiem przez wiele lat.
Prezentacja antyoksydantów
Jak już wiesz, istnieje wiele grup antyoksydantów. Dla nas najważniejsze są te, na które mamy największy wpływ, a więc egzogenne. To my poprzez konsumpcję będziemy w tym przypadku decydować o ich poziomie w organizmie. Przyjrzyjmy się, w jaki sposób poszczególne antyoksydanty spełniają swoje zadanie.
Przeciwutleniacze egzogenne
Witaminy
Witamina A
Głównymi postaciami witaminy A są retinol oraz 3,4-didehydroretinol. Dzięki zdolnościom wygaszania aktywnego tlenu singletowego retinoidy wykazują działanie przeciwnowotworowe [11].
Poprzez właściwości antyoksydacyjne, witamina A wpływa na wzrost i różnicowanie komórek nabłonków. W ten sposób zapobiega ich transformacji nowotworowej. Można to połączyć z działaniem prewencyjnym. Dodatkowo wykazuje działanie hamujące na nowotwory jamy nosowo-gardłowej, jelit, dróg oddechowych, przełyku, a także pęcherza moczowego, ograniczając jego przerost.
Prowadzono randomizowane badania w Chinach wśród około 30 000 osób. Należały one do grupy zwiększonego ryzyka występowania raka przełyku i żołądka. Badania wykazały, iż najkorzystniejsze efekty uzyskiwane są w przypadku przyjmowania witaminy A w połączeniu z innymi witaminami. Podobny efekt uzyskano z pierwiastkami śladowymi wykazującymi właściwości antyoksydacyjne.
Najniższa śmiertelność w badanych nowotworach wystąpiła u osób stosujących jednocześnie witaminę A, E, β-karoten oraz selen [12]. Nie wolno także zapominać, że jest kluczowa w procesie widzenia. Jest czynnikiem, który wpływa na wytworzenie komórek rozrodczych. Wspomaga układ odpornościowy. Przyczynia się do utrzymania prawidłowego stanu naskórka [13,14].
Witamina C
Witamina C jest składnikiem niezbędnym do prawidłowego funkcjonowania. Jest antyoksydantem. Pełni w komórkach istotną rolę w utrzymaniu prawidłowego potencjału oksydoredukcyjnego. Poprzez uczestnictwo w neutralizowaniu reaktywnych form tlenu i azotu chroni organelle komórkowe przed powstawaniem uszkodzeń oksydacyjnych.
Jest wysoce skutecznym przeciwutleniaczem, ze względu na zdolność do łatwego przekazywania elektronów. To pozwala jej chronić w ten sposób ważne biomolekuły (białka, lipidy, węglowodany i kwasy nukleinowe). Chroni je przed uszkodzeniem przez utleniacze powstające podczas normalnego metabolizmu komórkowego. Do uszkodzenia może także dojść poprzez ekspozycję na toksyny i zanieczyszczenia (np. dym papierosowy) [15].
Witamina C wspiera funkcję bariery nabłonkowej przed patogenami. Wspomaga działanie antyoksydacyjne skóry, tym samym potencjalnie chroniąc przed środowiskowym stresem oksydacyjnym [16,17]. Witamina ta jest również kofaktorem wielu enzymów.
Podawanie mikroelementów przeciwutleniających, w tym witaminy C, pacjentom z zaburzeniami gojenia się ran może skrócić czas upływający do zamknięcia się rany [18]. Jest witaminą odpowiedzialną za usuwanie licznych reaktywnych utleniaczy. Może regenerować ważne przeciwutleniacze komórkowe i błonowe. Można tu wymienić glutation i witaminę E [19].
Badania in vitro wykazały, że inkubacja witaminy C z limfocytami sprzyja proliferacji [20]. Skutkuje to zwiększonym wytwarzaniem przeciwciał [21]. Właściwości przeciwutleniające witaminy C umożliwiają jej ochronę komórek płuc. Komórki te są narażone na działanie utleniaczy. Mogą one być spowodowane przez różne zanieczyszczenia, metale ciężkie, pestycydy i inne ksenobiotyki [22].
Prowadzono doświadczenia przeprowadzone na liniach komórkowych. Wskazują na to, że witamina C w małym stężeniu funkcjonuje jako antyoksydant. Tym samym obniża liczbę uszkodzeń genetycznych. Konsumpcja kwasu askorbinowego z naturalnych źródeł (warzywa i owoce) chroni przed powstawaniem uszkodzeń DNA w komórkach ludzkich [23,24].
Witamina E
Nazwą „witamina E” określa się grupę pokrewnych chemicznych związków. Wśród nich największą aktywność biologiczną wykazuje D-α-tokoferol [25]. Głównym zadaniem witaminy E jest ochrona komórki przed utlenianiem lipidów [26]. Witamina E może mieć potencjalnie wpływ na zmniejszenie rozwoju miażdżycy, chorób serca. Wspomaga układ immunologiczny. Wiąże się ją z działaniem antynowotworowym, natomiast nie wszystkie badania są zgodne. Różne wyniki uzyskuje się, analizując konkretne nowotwory [13,27].
Składniki mineralne
Selen
Selen (Se) jest niezbędnym pierwiastkiem śladowym. Jego niski poziom u ludzi wiąże się ze zwiększonym ryzykiem rozwoju różnych chorób. Będą to między innymi nowotwory i choroby serca. Jest to ważny składnik enzymów antyoksydacyjnych, takich jak peroksydaza glutationowa [28].
Istnieje hipoteza, że obecność selenoenzymów i selenoprotein może przyczynić się do zmniejszenia produkcji utlenionego LDL [29]. Selen wiąże się także z potencjalnym działaniem antykancerogennym. Najbardziej możliwym działaniem Se jest jego rola w systemach obrony antyoksydacyjnej. Jest to ochrona polegająca na zmniejszeniu stresu oksydacyjnego i ograniczeniu uszkodzeń DNA [30]. Pełni także istotną rolę w układzie immunologicznym [31].
Cynk
Prowadzono badania nad rolą cynku (Zn) u osób starszych. Wykazały one, że częstość występowania infekcji zmniejszyła się o około 66% w grupie suplementującej cynk. Suplementacja cynkiem zmniejszyła również biomarkery stresu oksydacyjnego i zmniejszyła cytokiny zapalne. Stres oksydacyjny i przewlekłe stany zapalne są ważnymi czynnikami przyczyniającymi się do wielu chorób przewlekłych. Postępują one wraz z wiekiem. Do takich chorób należy miażdżyca, zaburzenia pracy serca, nowotwory, neurodegeneracja, zaburzenia immunologiczne i sam proces starzenia. Cynk jest bardzo skuteczny w zmniejszaniu reaktywnych form tlenu (RFT). To one powiązane są z procesami starzenia i możliwości rozwoju powyższych chorób [32].
Miedź
Miedź (Cu) może odgrywać rolę w chorobie sercowo-naczyniowej i chorobie Alzheimera. Jest kofaktorem kilku enzymów. Są one zaangażowane w produkcję energii, metabolizm żelaza, aktywację neuropeptydów, syntezę tkanki łącznej i syntezę neuroprzekaźników. Miedź bierze również udział w wielu procesach fizjologicznych. Bierze udział w procesach takich jak angiogeneza, homeostaza neurohormonów oraz regulacja ekspresji genów.
Jest też pierwiastkiem potrzebnym do rozwoju mózgu, pigmentacji i funkcjonowania układu odpornościowego. Jej działanie antyoksydacyjne wiąże się z tym, iż jest ona składnikiem dysmutaz ponadtlenkowych [33, 34, 35].
Żelazo
Żelazo jest niezbędne do prawidłowej pracy organizmu. Wiąże się to z funkcją, jaką pełni. Żelazo jest podstawowym składnikiem hemoglobiny, białka erytrocytów (czerwonych krwinek). Bierze udział w przenoszeniu tlenu z płuc do tkanek [36]. Jako składnik mioglobiny, innego białka dostarczającego tlen, żelazo wspomaga metabolizm mięśni i tkankę łączną.
Żelazo jest również niezbędne do wzrostu fizycznego, rozwoju metabolicznego, funkcjonowania komórek i syntezy niektórych hormonów [37]. Tematem głównym jednak są jego właściwości przeciwutleniające. Ten temat można określić jako niejasny. Źródła naukowe nie są jednoznaczne w prezentowanych informacjach. To zagadnienie jest szczególnie trudne, gdyż jego istota leży w zrozumieniu przemian biochemicznych z udziałem żelaza.
Jedne z aktualnych źródeł określają żelazo mianem antyoksydantu [3,38]. Nie wszystkie źródła za tym przemawiają. Według jednej z dostępnych publikacji wolne żelazo (niezwiązane z białkami) może katalizować powstawanie w organizmie reaktywnych form tlenu (ROS), w tym wolnych rodników. Reaktywne formy tlenu mogą uszkadzać cząsteczki, takie jak DNA, białka oraz lipidy. Jak można zauważyć, informacje są całkowicie rozbieżne, a trudność zagadnienia duża.
Najlepszą opcją jest dostarczanie dla naszego organizmu ilości żelaza zgodnej z naszym zapotrzebowaniem na ten składnik. Wówczas nie musimy obawiać się o negatywne konsekwencje zdrowotne.
Mangan
Mangan jest minerałem śladowym. Jest składnikiem mineralnym niezbędnym do wielu procesów organizmu, takich jak funkcjonowanie układu nerwowego i utrzymanie odporności. Mangan jest częścią przeciwutleniającego enzymu dysmutazy ponadtlenkowej (SOD) [39].
Jak można zauważyć, pierwiastki śladowe są niezbędne dla naszych organizmów. Pamiętać należy, że ani nadmiar, ani niedomiar nie są korzystne. Najlepszym sposobem na dostarczenie składników odżywczych jest zapoznanie się z dziennym zapotrzebowaniem. Można to zrobić, posługując się najnowszymi Normami Żywienia.
Związki aktywne
Karotenoidy
Karotenoidy pełnią ważne funkcje w świecie roślin. Odpowiadają one za stabilność błon lipidowych. Biorą udział w gromadzeniu światła w procesie fotosyntezy. Chronią przed procesem fotooksydacji wywołanym przez reaktywne formy tlenu. Formy te powstają podczas wzbudzenia chlorofilu w procesie fotosyntezy [40,41]. Działanie przeciwutleniające karotenoidów na błony lipidowe zależy od ich orientacji, lokalizacji oraz organizacji w błonach.
Karotenoidy charakteryzują się wysoką aktywnością wobec reaktywnych form tlenu, jak i wolnych rodników [40]. Porównano β-karoten z witaminą C i E. Wykazuje on wyższą aktywność antyoksydacyjną wobec tlenu singletowego, powstającego w procesie fotosyntezy [42]. Badania potwierdzają, że jednoczesne stosowanie β-karotenu oraz witamin C i E powoduje cofanie się miażdżycy!
α-karoten chroni komórki przed nadmiernym rozrostem. Stosowanie diety bogatej w luteinę, czy zeaksantynę, zapobiega powstaniu zaćmy i zwyrodnieniu plamki żółtej. Likopen jest efektywny w walce z rodnikiem tlenku azotu odpowiedzialnym za uszkodzenia limfocytów.
Badania potwierdzają jego zapobiegawcze właściwości wobec raka prostaty i szyjki macicy [42]. Badania kontrolne nad β-karotenem, potwierdzają jego działanie zapobiegające oparzeniom skóry u osób zdrowych. Niektóre karotenoidy, oprócz prowitaminy A wzmacniają odporność immunologiczną organizmu.
Kapsantyna i kapsarubina wykazują bardzo istotną dla organizmu aktywność neutralizującą tlen singletowy. Mają również inhibicyjny wpływ na peroksydację lipidów. Dodatkowo mogą być stosowane jako substancje przeciwdziałające rozwojowi nowotworów [43].
Co ciekawe, karotenoidy występują także w produktach pochodzenia zwierzęcego. Astaksantyna jest karotenoidem występującym dość często w organizmach morskich, np. w łososiu. Bez wątpienia królują jednak karotenoidy roślinne [44].
Polifenole
Polifenole możemy podzielić na polifenole nieflawonoidowe i flawonoidy. Wśród polifenoli nieflawonoidowych wyróżniamy: kwasy hydroksybenzoesowe, kwasy hydroksycynamonowe, stilbeny i lignany. Do głównych klas flowonoidów należą z kolei: izoflawonoidy, flawonole, flawony, flawanony, flawanole, czy antocyjanidy [45].
Działają przeciwcukrzycowo, prewencyjnie w chorobach nowotworowych, w osteoporozie, w chorobach układu krążenia [46]. Uważa się, że polifenole roślinne przeciwdziałają powstawaniu wrzodów żołądka i dwunastnicy.
Wrzody są wywoływane stresem, lekami i alkoholem [47]. Polifenole ekstrahowane z wina, w tym kwercetyna, skuteczniej hamują oksydację frakcji LDL niż tokoferole! Naturalne polifenole występujące w nasionach roślin oleistych stabilizują produkowane z nich oleje [48].
Najbardziej znane polifenole tego typu: kwercetyna, rutyna. Hamują one utlenianie masła, smalcu, tłuszczów rybich i olejów w stopniu zbliżonym do przeciwutleniaczy syntetycznych. Jednak skutkiem ubocznym może być powstawanie niekorzystnych dla naszego zdrowia związków [49]. Jak widzisz, funkcji korzystnych dla naszego zdrowia jest wiele. Nie sposób opisać je wszystkie ze względu na mnogość związków [50].
Przeciwutleniacze endogenne
Antyoksydanty egzogenne i endogenne współpracują ze sobą. Dobrym przykładem jest selen, który wchodzi w skład peroksydazy glutationowej. Podobnie jak w przypadku przeciwutleniaczy egzogennych nie sposób jest wspomnieć o każdym związku i jego funkcji. Nic jednak nie stoi na przeszkodzie, by scharakteryzować te najistotniejsze.
Glutation jako antyoksydant stabilizuje błony lizosomów i hamuje uwalnianie katabolicznych enzymów lizosomalnych. Ma także wpływ na odtruwanie organizmu. Kolejnym bardzo ważnym przeciwutleniaczem jest koenzym Q. Jest on rozpuszczalny w tłuszczach. Jest obecny we wszystkich błonach. Jego działanie ochronne rozciąga się na lipidy, białka i DNA.
Inny endogenny przeciwutleniacz to ferrytyna. Ferrytyna jest białkiem wiążącym żelazo. Główną funkcją ferrytyny jest ograniczanie ilości żelaza dostępnego do udziału w tworzeniu wolnych rodników tlenowych. Bilirubina odgrywa rolę w zapobieganiu uszkodzeniom niedokrwiennym serca. Bierze udział w tłumieniu uszkodzeń oksydacyjnych w hodowanych komórkach oraz modulowaniu kurczliwości mięśni gładkich dróg oddechowych. Bilirubina chroni również neurony przed uszkodzeniami wywołanymi nadtlenkiem wodoru.
Niezwykle istotne dla naszego organizmu są dysmutazy. Dysmutazy ponadtlenkowe (SOD) to grupa kluczowych enzymów funkcjonujących jako pierwsza linia obrony antyoksydacyjnej. Mają zdolność przekształcania wysoce reaktywnych rodników ponadtlenkowych (dysmutacji) w nadtlenek wodoru i tlen cząsteczkowy.
Kolejnym przeciwutleniaczem wartym wspomnienia jest katalaza. Katalaza to enzym zawierający porfirynę, który znajduje się głównie w peroksysomach. Katalizuje konwersję nadtlenku wodoru do wody i tlenu. Ostatnim opisywanym endogennym antyoksydantem będzie peroksydaza glutationowa (GPx).
Enzym ten może występować w dwóch formach: zależnej od selenu i niezależnej od selenu. GPx katalizuje redukcję nadtlenku wodoru lub nadtlenku organicznego do wody, czy alkoholu. Reakcja ma szczególne znaczenie w ochronie wielonienasyconych kwasów tłuszczowych znajdujących się w błonach komórkowych. Tam enzym działa jako część wieloskładnikowego systemu obrony antyoksydacyjnej w komórce [51,52,53,54,55,56,57,58].
Przeciwutleniacze syntetyczne
Przyszedł czas by zapoznać się ze związkami, na które nie mamy większego wpływu. Są to przeciwutleniacze syntetyczne. Wchodzą one w skład żywności. Zapewniają większą stabilność i wydajność, niskie koszty oraz szeroką dostępność. Najczęściej wymienianymi syntetycznymi przeciwutleniaczami w przemyśle spożywczym są butylowany hydroksyanizol (BHA), butylowany hydroksytoluen (BHT), galusan propylu (PG) i tert-butylohydrochinon (TBHQ).
Istnieje kilka opublikowanych badań wskazujących na związek między długotrwałym przyjmowaniem syntetycznych przeciwutleniaczy a niektórymi problemami zdrowotnymi. Te problemy to alergie skórne, problemy z przewodem pokarmowym, a w niektórych przypadkach zwiększone ryzyko nowotworu. Pamiętajmy jednak, że każdy związek nawet i ten naturalny, po przekroczeniu normy na jego spożycie, może być zagrożeniem dla życia i zdrowia [59].
Antyoksydanty w żywności
Naszym obowiązkiem jest dbać o nasze zdrowie. Żyjemy w społeczeństwie, w którym choroby się leczy, a nie zapobiega im. To duży błąd. Nikt jednak nie każe nam tak żyć. Mamy wpływ na nasze zdrowie. Zawdzięczamy to aktywności fizycznej, unikaniu używek, czy komponowaniu zbilansowanej, zdrowej diety. W tej sekcji dowiesz się, w jaki sposób dostarczać antyoksydanty z żywnością.
Witamina A
Do cennych źródeł witaminy A zalicza się masło, jajka, mleko i inne produkty mleczarskie. Jej duże ilości zawierają niektóre tłuste ryby, wątroba i podroby zwierzęce. Ze źródeł roślinnych można wyróżnić słodkie ziemniaki, jarmuż, rzeżuchę, szpinak, dynię [60].
Witamina C
Witaminę C dostarczamy głównie dzięki spożyciu warzyw i owoców. Wśród owoców wyróżniamypaprykę, natkę pietruszki, brukselkę, kalarepę, brokuły, kapustę, kalafior, czy szpinak. Wśród owoców wymienia się przede wszystkim acerolę, owoce dzikiej róży, porzeczki (czarne, czerwone, białe), truskawki, kiwi, grejpfruty, pomarańcze, cytryny, agrest, maliny [61].
Witamina E
Najwięcej tokoferoli zawierają oleje słonecznikowy, rzepakowy oraz sojowy, a także oliwa, kiełki pszenicy, migdały, orzechy laskowe, włoskie i ziemne [62].
Selen
Największe ilości selenu znajdziemy w orzechach, szczególnie brazylijskich, rybach (tuńczyk i łosoś), drobiu i pszenicy, w grzybach i jajach kurzych. Bardzo duże ilości selenu zawierają drożdże. Czekolada dostarcza również selenu, choć nie jest to bardzo znaczące źródło [63].
Cynk
Najlepszym źródłem cynku są ostrygi (może czas spróbować?). Inne to: wątróbka, kraby, sery żółte, kasza gryczana, jaja, ryż, ryby, pestki dyni, nasiona słonecznika [64].
Miedź
Do głównych źródeł miedzi zalicza się: wątrobę cielęcą, sezam, płatki owsiane, grzyby, drożdże piekarskie, pomidory, ostrygi, pełnoziarniste produkty zbożowe, ziarna słonecznika, orzechy, zielone warzywa liściaste, kakao oraz pestki dyni, tofu, czy czekoladę [65].
Żelazo
Produkty zwierzęce zawierające żelazo są najlepiej przyswajalną formą tego pierwiastka. Są to podroby (przede wszystkim wątroba cielęca i wołowa oraz nerki), ostrygi, mięso. Ryby nie są bogate w żelazo. Najcenniejsze produkty roślinne pod tym względem to: fasola, soczewica, groch, produkty zbożowe, kakao, natka pietruszki [66].

Mangan
Miedzi, możesz dostarczyć z: małżami, brązowym ryżem, orzechami laskowymi, ciecierzycą, szpinakiem, ananasem, chlebem pełnoziarnistym, czarną herbatą i z ziemniakami [67].
Karotenoidy [68]:
Likopen
Źródłem likopenu w diecie są warzywa o czerwonej barwie oraz niektóre owoce. Najpopularniejszym z nich jest pomidor. Inne to:arbuz, różowy grejpfrut, papaja, gujawa, owoce dzikiej róży.
Luteina
Luteina występuje w żółtych i pomarańczowych warzywach i owocach oraz zielonych liściach warzyw. Najlepszym jego źródłem jest jarmuż, szpinak, sałata, brokuły, cukinia. Warzywa to lepsze źródła luteiny aniżeli owoce.
Astaksantyna
Astaksantyna charakteryzuje się fioletowym zabarwieniem. Występuje w ciele jednokomórkowych glonów, drożdży, łososi, pstrągów, kryli, krewetek, raków i innych skorupiaków.
β- karoten
Źródłem pokarmowym β-karotenu są m.in. marchew, słodkie ziemniaki, papryka czerwona, arbuz, morele, dynia, brzoskwinia, papaja oraz szpinak.
Zeaksantyna
Naturalnym źródłem zeaksantyny są przede wszystkim warzywa, np. jarmuż, szpinak, brokuły, kukurydza, czy czerwona papryka.
β- kryptoksantyna
Szukaj jej w marchwi, pomarańczy, morelach, pomidorach, dyni, papai.
Polifenole:
Tabela 2. Występowanie związków polifenolowych w owocach (według własnego opracowania).
| Flawonole Kwercetyna Kempferol | Ciemne winogrona, jabłka, bez czarny, dzika róża, czereśnie, porzeczka czarna, truskawka, żurawina, aronia, czarna jagoda, malina. |
| Flawony Luteolina Apigenina | Jabłka, wiśnie, winogrona, cytryny. |
| Flawanony Hesperydyna Naringenina | Pomarańcze, grejpfruty. |
| Flawanole Katechina Epikatechina Epigalokatechina Proantocyjanidyny | Jabłka, brzoskwinie, czerwone winogrona. |
| Antocyjany Cyjanidyna Delfinidyna | Aronia, czarna porzeczka, truskawka, winogrona, wiśnie, bez czarny, borówka czernica, jeżyny, malina, poziomka, owoc granatu, żurawina. |
| Fenolokwasy Kwas kawowy Kwas chlorogenowy Kwas elagowy | Białe winogrona, jabłka, wiśnie, brzoskwinie, gruszki, borówka czernica, truskawka, winogrona, jabłka, jeżyny, żurawina, aronia, czarna porzeczka, malina, owoce granatu. |
Źródło: Gheribi E. (2011). Związki polifenolowe w owocach i warzywach. Medycyna rodzinna 4, 111-115.
Tabela 3. Zawartość związków polifenolowych w wybranych warzywach (według własnego opracowania).
| Brokuły świeże | Flawonole Kampferol Kwercetyna |
| Cebula żółta | Flawonole Kwercetyna |
| Fasola zielona świeża | Flawonole Kwercetyna |
| Gryka | Flawonole Kwercetyna |
| Pietruszka, korzeń | Flawony Apigenina Flawonole Mirycetyna |
| Pomidor czerwony świeży | Flawonole Kwercetyna |
| Seler, korzeń | Flawony Apigenina Luteolina Flawonole Kwercetyna |
| Szpinak świeży | Flawonole Kwercetyna |
Źródło: Gheribi E. (2011). Związki polifenolowe w owocach i warzywach. Medycyna rodzinna 4, 111-115.
Oprócz tego związki polifenolowe znajdziemy w przyprawach/ ziołach. Używaj takich jak: cynamon, goździki, curry, oregano, rozmaryn, szałwia, anyż, tymianek, bazylia, majeranek, mięta.
Co ciekawe, kakao, gorzka czekolada, wino, kawa to prawdziwe skarbnice tych związków!
Podsumowując powyższe rozważania, zauważ, że antyoksydanty pochodzą z różnych źródeł. W związku z tym nie ograniczaj ich i siebie! Jedz różnorodnie i ciesz się zdrowiem przez wiele, wiele lat.
Owoce jagodowe. Polskie superfoods jako źródło antyoksydantów
Owoce jagodowe to grupa roślin sadowniczych, których owocem jest jadalna jagoda. Wśród roślin jagodowych znajdują się: borówka wysoka, malina, jeżyna, agrest, aronia, porzeczka, jagoda kamczacka, truskawka, winorośl czy żurawina.
Do najważniejszych przeciwutleniaczy, które zawiera truskawka, należą witamina C i związki fenolowe. Spośród polifenoli w największej ilości występują antocyjany, a także kwas ellagowy i jego pochodne. Stanowią one 35-40% zawartości truskawki! W truskawkach występują flawonole reprezentowane przez kampferol, kwercetynę. Witamina C z kolei stanowi 15% pojemności antyoksydacyjnej tego owocu.
Do owoców bogatych w związki polifenolowe i witaminę C należy też porzeczka. Porzeczka czarna może się pochwalić większą ilością tych związków w porównaniu do czerwonej i białej porzeczki. 1/3 związków polifenolowych w porzeczce stanowią antocyjany. Fenolokwasy i flawonole obecne są w porzeczkach poza wymienionymi związkami. Wykazano, iż spożycie czarnej porzeczki podnosi znacząco poziom kwercetyny w surowicy krwi.
Aronia odznacza się wysoką zawartością polifenoli. Ponad połowę związków polifenolowych w tym owocu stanowią antocyjany. To one nadają jej barwę. W owocach rzadko antocyjany i proantocyjanidy występują obok siebie. Aronia to wyjątek od tej reguły. W aronii występują również fenolokwasy i flawonole.
Borówka to kolejne wspaniałe źródło antocyjanów. Coraz bardziej popularna w Polsce staje się jagoda kamczacka.Dotychczasowe badania naukowe potwierdziły szeroki zakres właściwości antyoksydacyjnych, ściśle związanych z aktywnością przeciwzapalną, antynowotworową, neuroprotekcyjną oraz kardioprotekcyjną tego owocu.

Związki fenolowe obecne w tej jagodzie to antocyjany, kwas chlorogenowy, kwercetyna. Jagoda ta zawiera unikalne związki irydoidowe. Można je odnaleźć w nielicznych owocach, takich jak dereń, żurawina czy borówki. Są one cenione ze względu na swoje działanie przeciwzapalne, przeciwbólowe, przeciwreumatyczne. Pozostałe owoce jagodowe podobnie jak ich siostry to również źródła związków polifenolowych i witaminy C. Pamiętaj o naszych rodzimych owocach. Warto dostrzegać to, co mamy na wyciągnięcie ręki [69], [70].
Czy właściwości antyoksydacyjne zmniejszają pod wpływem procesów technologicznych i temperatury?
Wydaję się, że odpowiedź na to pytanie powinna być twierdząca. Nie jest to jednak w każdym przypadku jednoznaczne. Zmniejszeniu zawartości naturalnych przeciwutleniaczy w produkcie może towarzyszy zwiększenie aktywności przeciwutleniającej.
Dzieje się tak ze względu na łatwiejszy dostęp pozostałych przeciwutleniaczy. Rozkład ścian komórkowych pod wpływem ogrzewania lub enzymatycznej hydrolizy zwiększa biodostępność β– karotenu. Nie wszystko jednak oddziałuje tak pozytywnie.
Obieranie, cięcie, czy rozdrabnianie warzyw albo owoców, obniża potencjał przeciwutleniający o 20 do 60% w stosunku do surowca wyjściowego [71]. Warzywa i owoce poddane blanszowaniu zachowują w większym stopniu swoją aktywność przeciwutleniającą w trakcie przechowywania niż surowce nieblanszowane [72].
Podobnie mrożenie jest dobrym sposobem przechowywania. Niesie ze sobą tylko niewielkie straty. W przypadku karotenoidów, a zwłaszcza likopenu i β -karotenu, nawet wysokotemperaturowe procesy, jak sterylizacja czy gotowanie, nie powodują dużych strat tych składników. Jednak termostabilność to cecha rzadko spotykana wśród przeciwutleniaczy.
Gotowanie jest procesem powodującym szybki dostęp ciepła do wnętrza tkanek. To również prowadzi do dużych strat przeciwutleniaczy. W tym miejscu warto wspomnieć o gotowaniu na parze. Ten rodzaj ogrzewania powoduje znacznie mniejszy spadek ilości antyoksydantów.
Czas gotowania jest równie ważny. Ogólnie im dłużej tym straty są większe, ale istnieją w tym przypadku pewne odstępstwa. Dotyczą one na przykład likopenu zawartego w pomidorach. Krótkotrwałe gotowanie nie jest większym powodem do obaw o nasze związki. Smażenie w tłuszczu, to działanie temperatury. Powoduje ono straty związków przeciwutleniających na skutek ich reakcji z powstającymi podczas rozkładu tłuszczu wolnymi rodnikami [73].
Pamiętaj o czasie przechowywania produktów w lodówce, czy na blacie w kuchni. Im dłuższy tym straty będą wyraźniejsze [74]. Szczególnie jest to widoczne w przypadku witaminy C. Trzeba też pamiętać, że sam proces dojrzewania owoców, czy warzyw ma wpływ na zawartość antyutleniaczy. Karotenoidy są intensywnie syntetyzowane w pierwszych etapach tworzenia się owoców. Po tym, jak dojrzeją, ich stężenie wyraźnie spada [44].
Czasem te zależności są nieoczywiste. Czy spodziewałeś się, że papryka rosnąca pod liściem ma zauważalnie mniej przeciwutleniaczy niż ta rosnąca na słońcu? [75].
Małe zmiany a duże korzyści. Jak stosując kilka zasad zwiększyć ilość antyoksydantów w diecie?
Może na początku wydaje Ci się to niezbyt prawdopodobne. Być może już sobie myślisz: ,,O nie! Specjalne diety to nie ja.’’ Uwierz mi, ja też nie. Możemy jednak wspólnie przeanalizować, co możemy zrobić, żeby w prosty sposób dostarczyć większą porcję antyoksydantów bez specjalnej diety.
Poniższe wskazówki mogą pomóc w zwiększeniu spożycia przeciwutleniaczy:
- Za każdym razem, gdy jesz, dołączaj owoce lub warzywa do posiłku. Zimą wskazane jest kupowanie mrożonek.
- Codziennie wypij filiżankę zielonej herbaty lub herbaty matcha.
- Spójrz na kolory na swoim talerzu. Jeśli twoje jedzenie jest w większości brązowe lub beżowe, poziom przeciwutleniaczy prawdopodobnie będzie niski. Dodaj produkty o bogatych kolorach, takie jak jarmuż, buraki i jagody.
- Użyj kurkumy, kminku, oregano, imbiru, goździków i cynamonu, aby urozmaicić smak i zawartość przeciwutleniaczy w posiłkach.
- Na przekąskę wybierz orzechy, nasiona, zwłaszcza orzechy brazylijskie, nasiona słonecznika i suszone owoce. Wybieraj te bez dodatku cukru lub soli.
- W miarę możliwości staraj się zastąpić smażenie i gotowanie, chociażby gotowaniem na parze. Jeśli jest to możliwe, spożywaj produkty w formie nieprzetworzonej.
- Czerwone wino, czy kostka gorzkiej czekolady to dobry pomysł raz na jakiś czas. Przecież ty nie jesz czekolady dla przyjemności, a dla przeciwutleniaczy. Wiadomo!
Te kilka porad wystarczy na dobry początek. W zasadzie to chyba dużo więcej niż połowa sukcesu!
Jak rozpoznać produkt zawierający duże ilości antyoksydantów? Skala ORAC i nie tylko
Teraz zapoznamy się z bardziej specjalistycznym zagadnieniem. Mianowicie omówimy, w jaki sposób znakowana jest żywność pod względem wartości antyoksydacyjnej. Służą do tego specjalne skale.
Najczęściej korzystamy ze skali ORAC. Skala ORAC (oxygen radical absorbance capacity) określa zdolność wiązania rodników nadtlenkowych przez przeciwutleniacze. Pomaga określić skuteczność danego produktu zawierającego przeciwutleniacze w walce z wolnymi rodnikami.
Im większy mamy potencjał antyoksydacyjny porcji/dawki, tym lepiej. Wartości ORAC zostały przeliczone dla porcji artykułów żywnościowych o masie 100 g i wyrażone w mikromolach TE (równoważnikach troloksu, pochodnej witaminy E).
W tabeli dawką lub porcją jest ilość na 100 g, czy ilość w połowie filiżanki, albo jako sztuka. W 2007 roku Departament Rolnictwa USA (United States Department of Agriculture, USDA) upublicznił spis wartości ORAC dla 277 artykułów spożywczych pochodzenia roślinnego. Odsyłam Cię do tego dokumentu. Uchylę rąbka tajemnicy. Cynamon, aronia, fasola, czarna jagoda, borówka, żurawina, kakao są naprawdę wysoko uplasowane.
Inne skale, które mogą Cię zainteresować to:
- TEAC (trolox equivalent antioxidant capacity) oznaczający ekwiwalent potencjału przeciwutleniającego troloksu w reakcji z rodnikiem ABTS. Zaletą tego testu, w porównaniu z innymi, jest możliwość jego stosowania w szerokim zakresie pH.
- Voltamperometria cykliczna CV (cyclic voltammetry) pozwala wyznaczyć całkowitą zdolność redukcyjną przeciwutleniaczy niskocząsteczkowych. Stosowana jest do badania w przypadku olejów roślinnych, warzyw i owoców.
- TRAP(total radical-trapping antioxidant parameter) oznacza całkowitą zdolność wiązania wolnych rodników. Spektrofotometryczną wersję tej metody stosuje się m.in.do badania czerwonego i białego wina.
Zaletą zapoznania się, chociażby ze skalą ORAC jest kolokwialne „otworzenie oczu”. Często nie zdajemy sobie sprawy, jak proste zmiany mogą wpływać na jakość naszego życia. Nie wiemy jak cenne dla naszego zdrowia produkty mamy w kuchni [77, 78, 79].
Czy istnieje ilość dostarczanych z żywnością antyoksydantów, którą można określić jako bezpieczną?
Co do zasady związki przeciwutleniające oddziałują w sposób pozytywny na nasz organizm. Przyglądając się jednak dokładniej, nie jest to zawsze prawda. Osobnej uwagi wymaga, chociażby β– karoten. Zaobserwowano wzrost śmiertelności osób otrzymujących dawki tego przeciwutleniacza jako suplementu diety. Podobnie zwiększenie zapadalności na nowotwory.
Było to szczególnie widoczne u palaczy i osób narażonych na kontakt z azbestem [80,81]. Wykazano również w badaniach in vitro, że karotenoidy nie zabezpieczają w sposób istotny frakcji cholesterolu LDL przed peroksydacją. Dodatkowo w pewnych sytuacjach stają się, w same wolnymi rodnikami wykazując działanie prooksydacyjne.
Podobnie może oddziaływać witamina C lub E [82]. Witamina E, która miała zapobiegać chorobom serca, może zwiększać ryzyko zgonu na skutek chorób układu krążenia. Nie ma również danych dotyczących toksyczności flawonoidów w stosunku do człowieka. Pojawiają się obawy dotyczące dojrzewania płciowego niemowląt otrzymujących bardzo wysoki poziom izoflawonów w mieszankach na bazie soi.
Zmiany niekorzystne mogą dziać się w przypadku nadmiaru składników mineralnych. Mogą one skutkować zmęczeniem, problemami z układem pokarmowym. Trudno jest określić ogólną specyfikę. Jeszcze jedno jest pewne. Trudno obecnie ustalić skuteczne i bezpieczne dawki poszczególnych przeciwutleniaczy. Zwłaszcza dotyczy to ich kombinacji w całodziennej diecie, toteż wzbogacanie produktów naturalnych w przeciwutleniacze, a tym bardziej suplementację należy uznać za działania przedwczesne i dyskusyjne.
Suplementacja może dotyczyć osób, które po konsultacji z lekarzem otrzymały takie zalecenie. Pamiętaj, że zdrowa, zbilansowana dieta to nasz sprzymierzeniec. Żadne kapsułki, czy syropy nie są w stanie zastąpić tego efektu. Działają one kierunkowo. Żywność pozwala uzupełniać naszą dietę w wiele składników. Bezpieczną dawkę można ustalić w przypadku witamin, czy składników mineralnych. W tym celu możesz posłużyć się Normami Żywienia [83,84].
Najpotężniejsze przeciwutleniacze na świecie
W tej sekcji poruszony zostanie temat najciekawszych i najpotężniejszych przeciwutleniaczy. Pierwszy z nich to hydroksytyrozol. Znajduje się on przede wszystkim w oliwce. Dokładniej w jej owocach, liściach i miąższu. Jego zdolność do absorbowania wolnych rodników oraz ochrony komórek i mitochondriów przed uszkodzeniem jest imponująca. Przeprowadzono badania na ludziach, zwierzętach i in vitro. Hydroksytyrozol zmniejsza markery stanu zapalnego. Wspiera funkcje mitochondriów i znacznie zwiększa produkcję energii ATP. Pomaga powstrzymać utratę struktury kości. Pomaga poprawić profile lipidów we krwi. Wspiera wzrok. Ma pozytywny wpływ na układ sercowo-naczyniowy. Chroni przed oksydacyjnym uszkodzeniem DNA w ludzkich komórkach piersi. Zmniejsza skutki neuropatii obwodowej [85].
Astaksantyna powinna nam się kojarzyć z łososiem, owocami morza. Przypuszcza się jej wielostronność działań. Może mieć ona wpływ na aktywność fizyczną. Wspiera zdrowie i wygląd skóry. Wzmacnia zdrowie układu sercowo-naczyniowego. Poprawia jakość snu. Wpływa na pracę oczu, zahamowanie rozwoju chorób układu nerwowego, poprawia płodność u mężczyzn, czy wzmacnia naszą odporność [86]. Na początek wystarczy wprowadzenie do twojej diety tych dwóch herosów.
Antyoksydanty w kosmetykach
Na koniec nie odchodząc od tematu głównego, sprawdzimy rolę przeciwutleniaczy w kosmetykach. Ich stężenie w danym produkcie jest niewielkie, ponieważ oscyluje w granicach 0.001%- 1%. Antyoksydanty wykorzystywane w kosmetyce powinny charakteryzować się nietoksycznością, tolerancją skórną, odpornością na działanie czynników fizycznych i chemicznych, trwałością w podwyższonej temperaturze oraz wysoką skutecznością w niewielkich stężeniach.
Wśród naturalnych antyoksydantów roślinnych wyróżnia się sylimarynę, kurkuminę oraz piknogenol. Jeśli chodzi, o witaminy to są to: witamina C, E i β– karoten. Kwercetyna, koenzym Q 10, czy pestki winogron są często spotykanymi składnikami.
Przeciwutleniacze zawarte w produktach do pielęgnacji skóry mają zdolność wnikania w najgłębsze warstwy skóry. Mogą umożliwić żywym komórkom naprawę i odnowę. Efektem jest skóra, która wygląda i czuje się młodziej! Oprócz tego wzmacniają struktury kolagenu i elastyny. Mają też wpływ na redukcję zmarszczek. Zapobiegają powstawaniu przebarwień skórnych.
Poszukaj przeciwutleniaczy w swoich kosmetykach. Najlepiej, jeśli będą to te pochodzenia naturalnego [87].
Podsumowanie
Antyoksydanty są nam niezbędne. Pamiętaj, że proste modyfikacje diety pomogą Ci dostarczyć większej ilości tychże związków. Dbaj o siebie. Zbilansowana i różnorodna dieta to twój klucz do zdrowia i zdrowego samopoczucia.
Chcesz dowiedzieć się więcej? Zapraszamy do nagrania webinaru:
Bibliografia:
- Piszcz P., Wantusiak P., Głód B.K. & Kubiak M.S.(2010). Antyoksydanty w produktach spożywczych, ich rola i właściwości. Postępy techniki przetwórstwa spożywczego, str.82-86.
- Uniwersytet Jagielloński (bdw). Biochemia stresu oksydacyjnego. Pobrano z http://biotka.mol.uj.edu.pl/zbm/handouts/2010/AJ/stres_oksydacyjny/Wyklad-1-final.pdf. Data dostępu: 10.09.2021r.
- Flieger J., Flieger W., Baj J., Maciejewski R. (2021). Antioxidants: Classification, Natural Sources, Activity/Capacity Measurements, and Usefulness for the Synthesis of Nanoparticles. MDPI, Materials. 14,4135. https://doi.org/10.3390/ma14154135
- Salehi B. i inn. (2018). Antioxidants: Positive or Negative Actors?. Biomolecules, 8(4), 124. https://doi.org/10.3390/biom8040124
- Halliwell B. Gutteridge J.M. (1990) The antioxidants of human extracellular fluids. Arch. Biochem. Biophys.;280:1–8. doi:10.1016/0003-9861(90)90510-6.
- Mut-Salud N. i inn. (2016). Antioxidant intake and antitumor therapy: Toward nutritional recommendations for optimal results. Oxid. Med. Cell. Longev.;2016:6719534. doi:10.1155/2016/6719534.
- Lawenda B.D. i inn. (2008). Should supplemental antioxidant administration be avoided during chemotherapy and radiation therapy? J. Natl. Cancer Inst.;100:773–783. doi:10.1093/jnci/djn148.
- MRS Blog (bdw). Benefits of antioxidants. Pobrano z http://www.msrblog.com/science/health/benefits-of-antioxidants.html. Data dostępu 12.09.2021r.
- Manivannan J., Silambarasan T., Shanthakumar J., Suganya N.& Kanchana S. (2016) Role of Antioxidants in Human Health. In: Hegde M., Zanwar A., Adekar S. (eds) Omega-3 Fatty Acids. Springer, Cham. https://doi.org/10.1007/978-3-319-40458-5_36
- Wolski T., Kalisz O., Gerkowicz M. & Smorawki M. (2007). Rola i znaczenie antyoksydantów w medycynie ze szczególnym uwzględnieniem chorób oczu. Borgis- Postępy Fitoterapii 2, s. 82-90
- Allecou DM. (2002). Przydatność witamin antyoksydacyjnych w profilaktyce i terapii guzów złośliwych jamy ustnej. Pozn Stomatol; 29: 57-61.
- Rutkowski M, Grzegorczyk K & Malinowska K. (2010). Witaminy A, C, E- rola ich działania antyoksydacyjnego w prewencji ontogenezy. Probl Ter Monitor; 21(4): 251-257.
- Kulik- Kupka K. i inn. (2016). Witaminy w walce z nowotworami. Med Rodz; 1(19): 26-31
- Rucker R.B., Suttie J.W., McCorrnick D.B. & Machlin L.J. (2001). Handbook of vitamins. ISBN: 0-8247-0428-2
- Carr A. & Frei B. (1999). Does vitamin C act as a pro-oxidant under physiological conditions? FASEB J.;13:1007–1024.
- Valacchi G. i inn. (2015). Vitamin C compound mixtures prevent ozone-induced oxidative damage in human keratinocytes as initial assessment of pollution protection. PLoS ONE;10:e0131097. doi:10.1371/journal.pone.0131097.
- Valacchi G. i inn. (2016). Ozone-induced damage in 3D-skin model is prevented by topical vitamin C and vitamin E compound mixtures application. J. Dermatol. Sci.;82:209–212. doi:10.1016/j.jdermsci.2016.02.007.
- Desneves K.J., Todorovic B.E., Cassar A. & Crowe T.C. (2005). Treatment with supplementary arginine, vitamin C and zinc in patients with pressure ulcers: A randomised controlled trial. Clin. Nutr.;24:979–987. doi:10.1016/j.clnu.2005.06.011
- Buettner G.R. (1993). The pecking order of free radicals and antioxidants: Lipid peroxidation, alpha-tocopherol, and ascorbate. Arch. Biochem. Biophys.;300:535–543. doi:10.1006/abbi.1993.1074.
- Huijskens M.J. i inn. (2014). Technical advance: Ascorbic acid induces development of double-positive T cells from human hematopoietic stem cells in the absence of stromal cells. J. Leukoc. Biol.;96:1165–1175. doi:10.1189/jlb.1TA0214-121RR.
- Tanaka M., Muto N., Gohda E. & Yamamoto I. (1994). Enhancement by ascorbic acid 2-glucoside or repeated additions of ascorbate of mitogen-induced IgM and IgG productions by human peripheral blood lymphocytes. Jpn. J. Pharmacol.;66:451–456. doi:10.1254/jjp.66.451.
- Haryanto B., Suksmasari T., Wintergerst E. & Maggini S. (2015). Multivitamin supplementation supports immune function and ameliorates conditions triggered by reduced air quality. Vitam. Miner.;4:1–15.
- Carr, A. C., & Maggini, S. (2017). Vitamin C and Immune Function. Nutrients, 9(11), 1211. https://doi.org/10.3390/nu9111211
- Konopacka M. (2004). Rola witaminy C w uszkodzeniach oksydacyjnych DNA. Postępy Hig Med Dosw. (online); 58: 343-348
- Jośko J, Ratman R & Ratman K. (2008). Angioprewencyjna rola witamin. Współcz Onkol; 12(4): 168-172.
- Pryor W.A. (2000). Vitamin E and heart disease: basic science to clinical intervention trials. Free Rad. Biol. Med.; 28: 141-164
- Stolarzewicz I.A., Ciekot J., Fabiszewska U. & Białecka-Florjańczyk E. (2013). Roślinne i mikrobiologiczne źródła przeciwutleniaczy. Postepy Hig Med Dosw (online); 67: 1359-1373e-ISSN 1732-2693
- Tapiero H, Townsend D.M & Tew K.D. (2003) The antioxidant role of selenium and seleno-compounds. Biomed Pharm.;57:134–44.
- Furman C. i inn. (2004). Thioredoxin reductase 1 is upregulated in atherosclerotic plaques: specific induction of the promoter in human macrophages by oxidized low-density lipoproteins. Free Radic Biol Med.;37:71–85.
- Rayman M.P. (2005). Selenium in cancer prevention: a review of the evidence and mechanism of action. Proc Nutr Soc.;64:527–42.
- Tinggi U. (2008). Selenium: its role as antioxidant in human health. Environmental health and preventive medicine, 13(2), 102–108. https://doi.org/10.1007/s12199-007-0019-4
- Prasad A. S. (2014). Zinc is an Antioxidant and Anti-Inflammatory Agent: Its Role in Human Health. Frontiers in nutrition, 1, 14. https://doi.org/10.3389/fnut.2014.00014
- Collins JF. I inn. (2014). Copper. Modern Nutrition in Health and Disease. 11th ed. Baltimore, MD: Lippincott Williams & Wilkins: 206-16.
- National Institutes of Health (2021). Copper. Fact Sheet for Health Professionals. Pobrano z https://ods.od.nih.gov/factsheets/Copper-HealthProfessional/. Data dostępu 14.09.2021r.
- Allen K.G. & Klevay L.M. (1994). Copper: an antioxidant nutrient for cardiovascular health. Curr Opin Lipidol;5:22-8.
- Wessling-Resnick M. i inn. (2014). Iron. Modern Nutrition in Health and Disease. 11th ed. Baltimore, MD: Lippincott Williams & Wilkins;176-88.
- Aggett P.J. i inn. (2012). Iron. Nutrition. 10th ed. Washington, DC: Wiley-Blackwell;506-20.
- Kopczyńska D., Klasik-Ciszewska S. & Duda-Grychtoł K. (2018). Produkty pszczele w pielęgnacji skóry. Med Rodz; 21(1): 48-5. DOI: https://doi.org/10.25121/MR.2018.21.1.48
- Nourish by WebMD (bdw.) Healthy Foods High in Manganese. Pobrano z https://www.webmd.com/diet/foods-high-in-manganese#2. Data dostępu 14.09.2021r.
- Andersson SC. (2009). Carotenoids, tocochromanols and chlorophylls in sea buckthorn berries (hippophae rhamnoides) and rose hips (rosa sp.). Doctoral Thesis Swedish University of Agricultural Sciences, Alnarp; 15-20.
- Simkin A.J. i inn. (2008). An investigation of carotenoids biosynthesis in Coffea canephora and Coffea arabica. J Plant Physiol; 165:1087-106.
- Ziemlański Ś. (2001). Normy żywienia człowieka. Fizjologiczne podstawy. Wyd Lek PZWL, Warszawa; 141-6, 301-2.
- Maoka T. (2009). Recent progress in structural studies of carotenoids in animals and plants. Arch Biochem Biophys; 483:191-5.
- Gryszczyńska A., Gryszczyńska B. & Opala B. (2011). Karotenoidy. Naturalne źródła, biosynteza, wpływ na organizm ludzki. Postępy Fitoterapii, str.127-143.
- Kosiorek A., Oszmiański J. & Golański J. (2013). Podstawy do zastosowania polifenoli roślinnych jako nutraceutyków o właściwościach przeciwpłytkowych. Postępy Fitoterapii, str.108-117.
- Koszowska A., Dittfeld A., Puzoń-Brończyk A., Nowak J. & Zubelewicz-Szkodzińska B. (2013). Polifenole w profilaktyce chorób cywilizacyjnych. Postępy fitoterapii, str. 263-266.
- Hirayama T. (1982). Relationship of soybean paste soup intake to gas-tric cancer risk. Nutr Can; 3:223-33.
- Oszmiański J. (1995). Polifenole jako naturalne przeciwutleniacze w żywności. Przem. Spoż., 3, 94-96.
- Szymusiak H., Oszmiański J. & Tyrakowska B. (1999). Trwałe i nietrwałe produkty utleniania flawonoidów. Mat. II Konf. Nauk. „Żywność a Zdrowie”, s. 83.
- Szajdek A. & Borowska J. (2004). Właściwości przeciwutleniające żywności pochodzenia roślinnego. Żywność. Nauka. Technologia. Jakość, 4 (41) S, 5- 28.
- Clark J.E. i inn. (2000). Heme oxygenase-1-derived bilirubin ameliorates postischemic myocardial dysfunction. Am J Physiol Heart Circ Physiol. 278: H643–H651.
- Foresti R., Sarathchandra P., Clark J.E., Green C.J. & Motterlini R. (1999). Peroxynitrite induces haem oxygenase-1 in vascular endothelial cells: a link to apoptosis. Biochem J. 339:729–736.
- Samb A. i inn. (2002). Heme oxygenase modulates oxidant-signaled airway smooth muscle contractility: role of bilirubin. Am J Physiol Lung Cell Mol Physiol. 283: L596–L603.
- Dore S. & Snyder S.H. (1999). Neuroprotective action of bilirubin against oxidative stress in primary hippocampal cultures. Ann NY Acad Sci. 890:167–172.
- Wang W. i inn. (2016). Gene expression characteristics and regulation mechanisms of superoxide dismutase and its physiological roles in plants under stress. Biochemistry (Mosc.) 81 (5): 465–480.
- Valko M., Rhodes C.J., Moncol, J., Izacovic M. & Mazur M. (2006). Free radicals, metals and antioxidants in oxidative stress-induced cancer. Chem Biol Interact. 160: 1–40.
- Gathwala G. & Aggarwal R. (2016). Selenium supplementation for the preterm indian neonate. Indian J Public Health. 60: 142–144.
- Aguilar A.A.F., Hernández Navarro B.C. & Mendoza Pérez J.A.( 2016). Endogenous Antioxidants: A Review of their Role in Oxidative Stress. IntechOpen, DOI: 10.5772/65715. Available from: https://www.intechopen.com/chapters/52680
- Lourenço S. C., Moldão-Martins M. & Alves V. D. (2019). Antioxidants of Natural Plant Origins: From Sources to Food Industry Applications. Molecules (Basel, Switzerland), 24(22), 4132. https://doi.org/10.3390/molecules24224132
- National Institutes of Health (NIH). Vitamin A. Fact Sheet for Health Professionals. Pobrano z https://ods.od.nih.gov/factsheets/VitaminA-HealthProfessional/. Data dostępu 15.09.2021r.
- Janda K., Kasprzak M. & Wolska J. (2015). Witamina C- budowa, właściwości, funkcje i występowanie. Pom J Life, 61, 4, 419–425
- Milanovic B. (2016). Witamina E- co kryje świat tokoferoli? Świat przemysłu farmaceutycznego- suplementy diety 3, str.112-116.
- Kieliszek M. (2019). Selenium–Fascinating Microelement, Properties and Sources in Food. Molecules, 24, 1298. https://doi.org/10.3390/molecules24071298
- National Institutes of Health (2021). Zinc. Fact Sheet for Health Professionals. Pobrano z https://ods.od.nih.gov/factsheets/Zinc-HealthProfessional/
- National Institutes of Health (2021). Copper. Fact Sheet for Health Professionals. Pobrano z https://ods.od.nih.gov/factsheets/Copper-HealthProfessional/
- National Institutes of Health (2021). Iron. Fact Sheet for Health Professionals. Pobrano z https://ods.od.nih.gov/factsheets/Iron-HealthProfessional/
- Nourish by WebMD (bdw.) Healthy Foods High in Manganese. Pobrano z https://www.webmd.com/diet/foods-high-in-manganese#2
- Igielska-Kalwat J., Gościańska J. & Nowak I. (2015). Karotenoidy jako naturalne antyoksydanty.Postepy Hig Med Dosw (online), 69: 418-428e-ISSN 1732-2693
- Piotrowska A., Góralczyk M. & Żebrowska- Krasuska M. (2013). Owoce jagodowe i ich przetwory jako źródła przeciwutleniaczy. Postępy techniki przetwórstwa spożywczego, 2, str. 98-103.
- Szot I., Lipa T. & Sosnowska B. (2014). Jagoda kamczacka – właściwości prozdrowotne owoców i możliwości ich zastosowania. Żywność. Nauka. Technologia. Jakość. Tom 21, numer 4, s.18-29.
- McCarthy M.A. & Mathews R.H. (1994). Nutritional quality of fruits and vegetables subjected to minimal process. In: Minimally Processed Refrigerated Fruits and Vegetables.
- Chu Y.H., Chang C.L. & Hsu H.F. (2000). Flavonoid content of several vegetables and their antioxidant activity. J. Sci. Food Agric., 80, 561-566.
- Grajek W. (2003). Zmiany potencjału przeciwutleniającego surowców roślinnych w procesach przetwórczych i w czasie trawienia. Żywność. Nauka. Technologia. Jakość, 4 (37), 26-35.
- Gumul D., Korus J. & Achremowicz B. (2005). Wpływ procesów przetwórczych na aktywność przeciwutleniającą surowców pochodzenia roślinnego. Żywność. Nauka. Technologia. Jakość, 4 (45) Supl., 41- 48
- Grajek W. (2007). Przeciwutleniacze w żywności. Aspekty zdrowotne technologiczne molekularne i analityczne. Wydawnictwa Naukowo-Techniczne.
- Ware M. (2018). How can antioxidants benefit our health? Pobrano z https://www.medicalnewstoday.com/articles/301506. Data dostępu 16.09.2021r.
- Wawrzyniak A., Krotki M. & Stoparczyk B. (2011). Właściwości antyoksydacyjne warzyw i owoców. Medycyna Rodzinna 1, str. 19-23.
- Chevion S. i inn. (1997). Evaluation of plasma low molecular weight antioxidant capacity by cyclic voltammetry. Free Radic Biol Med; 22, 411-421.
- Wayner D.D.M. (1985). Quantitaive mesurement of total peroxyl radical-trapping antioxidant capacity of human blood plasma by controlled peroxidation. FEBS; Lett 187, 33-37.
- Omenn G. S. i inn. (1996). Effects of a combination of beta carotene and vitamin A on lung cancer and cardiovascular disease. The New England J. of Med., 334, 1150-1155.
- Smigel K. (1996). Beta carotene fails to prevent cancer in two major studies: CARET intervention stopped. Journal of the National Center Institute, 88, 145.
- Jialal I. & Fuller C. J. (1995). Effect of vitamin E, vitamin C and beta-carotene on LDL oxidation and atherosclerosis. Can. J. Cardiol., 11 Suppl. G: 97G-103G.
- Czerwiecki L. (2009). Współczesne poglądy na rolę przeciwutleniaczy roślinnych w profilaktyce chorób cywilizacyjnych. Roczn. PZH, 60, nr 3, 201-206
- Musielińska R. & Bus B. (2015). Przegląd wybranych antyoksydantów w aspekcie bezpieczeństwa ich stosowania. Technika, Informatyka, Inżynieria Bezpieczeństwa, tom 3, str. 93-112. http://dx.doi.org/10.16926/tiib.2015.03.0
- Richards K.L. (2019). The Most Powerful Natural Antioxidant Discovered to Date- Hydroxytyrosol. Pobrano z https://www.prohealth.com/library/the-most-powerful-natural-antioxidant-discovered-to-date-hydroxytyrosol-29641. Data dostępu 18.09.2021r.
- Blog xwerks (2019). Astaxanthin: The Most Powerful Antioxidant You’ve Never Heard Of. Pobrano z https://xwerks.com/blogs/xwerks/astaxanthin-the-most-powerful-antioxidant-you-ve-never-heard-of. Data dostępu 18.09.2021r.
- Singh M. (2013). The Role of Antioxidants In Dermatological & Cosmetic Formulas. Pobrano z https://www.happi.com/issues/2013-12/view_features/the-role-of-antioxidants-in-dermtological-cosmetic-formulas/. Data dostępu 17.09.2021r.







