Puryny to związki heterocykliczne, które zawierają oprócz atomów węgla również inne atomy np. azotu. Mają charakter planarny, co ułatwia ułożenie ich warstwami oraz bliskie oddziaływania stabilizujące dwuniciową helisę DNA. W organizmie ludzkim dochodzi do syntezy wystarczającej ilości nukleotydów purynowych i pirymidynowych z amfibolicznych związków pośrednich. Jednak puryny są obecne także w żywności. Nukleoproteiny nie wbudowują się bezpośrednio do kwasów nukleinowych człowieka. Ich spożycia nie uznaje się za niezbędne do funkcjonowania [2].
Dlaczego puryny interesują żywieniowców?
Kwasy nukleinowe są obecne w każdej żywej komórce, zarówno zwierzęcej, jak i roślinnej. W dietetyce były one dotychczas uznawane za mało istotny składnik żywności, gdyż według szacunków ich zawartość w pożywieniu to około 5%. Ich ilość w badanym surowcu jest wyrażana zazwyczaj jako zawartość puryn. Obecnie stały się one przedmiotem zainteresowania wielu badaczy. Zazwyczaj wiedzę na temat związków purynowych stosuje się w profilaktyce oraz leczeniu dny moczanowej, jednak okazuje się, że istnieje wiele wad metabolizmu puryn [1].
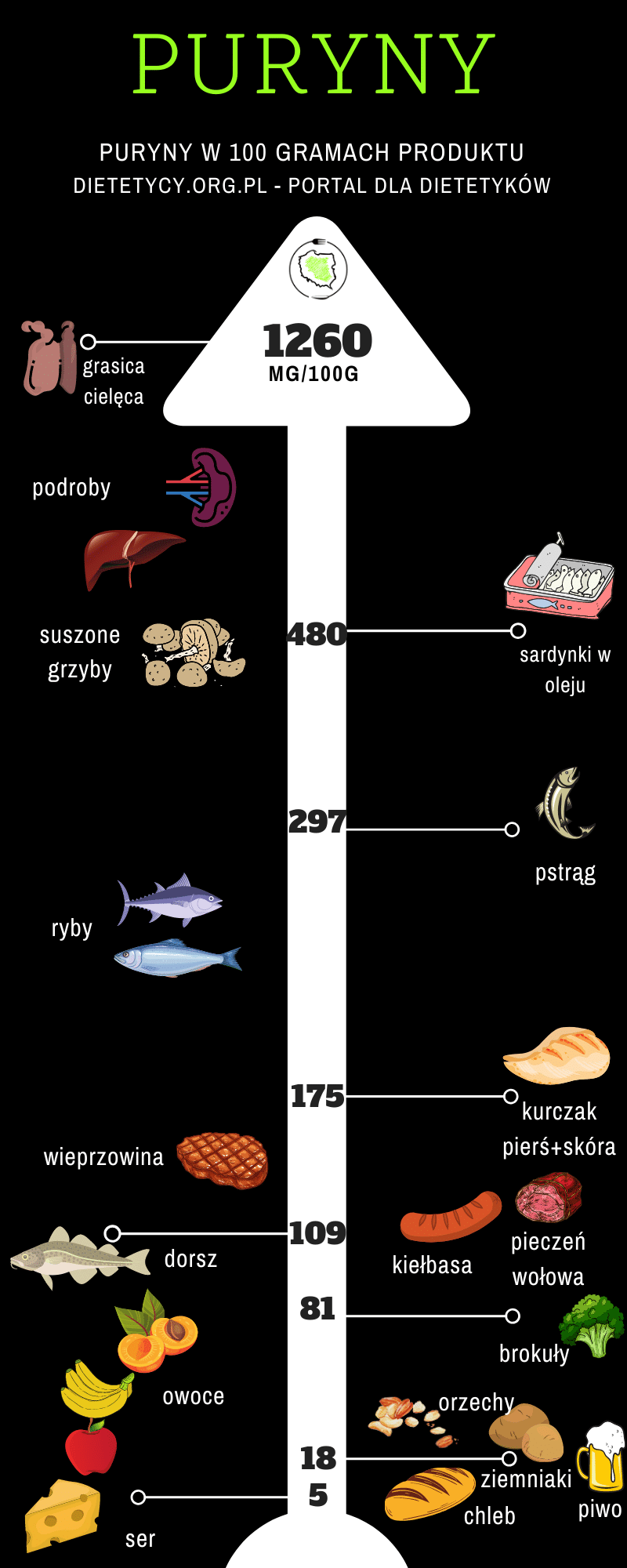
Puryny tabela z zawartością puryn
| Ilość puryn | |
| Bardzo duża | Śledzie, wyciągi mięsne, sardynki, nerkówka, drożdże |
| Duża | Sardele, boczek, fasola, soczewica, wątroba, łosoś, małże, pstrąg, indyk, cielęcina, mózg, dziczyzna |
| Umiarkowana | Kurczak, ostrygi, dorsz, łupacz, szpinak, szynka |
Pobierz w wersji PDF poniżej:
Dieta ubogopurynowa
Osoby z zaburzeniami metabolizmu puryn powinny stosować dietę ubogopurynową. Polega ona na ograniczaniu spożycia związków purynowych do 300 mg dziennie. W okresie zaostrzenia dolegliwości lub wysokiego stężenia kwasu moczowego we krwi nawet do 120 mg.
Zasady diety ubogopurynowej
Istotne jest spożywanie 4-5 posiłków dziennie w regularnych odstępach czasu. Ostatni posiłek powinien być spożyty minimum 3 godziny przed snem ze względu na wzrost ilości zatrzymywanego kwasu moczowego w organizmie. Dieta powinna być prawidłowo zbilansowana, czyli realizować zapotrzebowanie na wszystkie makro- i mikroskładniki.
W jadłospisie nie powinien przeważać tłuszcz, gdyż nasila on zwrotne wchłanianie moczanów w kanalikach. Rekomendowana jest dieta wysokowęglowodanowa, gdyż zwiększa wydalanie tych związków z moczem.
Preferowana obróbka termiczna żywności:
- gotowanie w dużej ilości wody
- duszenie bez obsmażania
- pieczenie bez dodatku tłuszczu
Aby zmniejszyć zawartość puryn w produktach, stosuje się również tzw. podwójne gotowanie. Niedozwolone są zupy i sosy na wywarach kostnych, mięsnych, grzybowych oraz potrawy smażone, pieczone z tłuszczem, duszone z wcześniejszym obsmażaniem.
Potrawy można doprawiać zawiesinami z mąki i mleka. Natomiast warzywa i owoce powinno podawać się w postaci gotowanej lub surowej np. surówek lub soków. Niezmiernie ważne jest wypijanie przez pacjenta dużej ilości płynów (około 3 l/dzień). Najlepiej wybrać wody mineralnej lub alkalicznej. Należy utrzymać także abstynencję alkoholową [14].

Puryny – źródła w diecie
W jadłospisie należy unikać produktów wysokopurynowych. Źródłem puryn w diecie są przede wszystkim mięso (głównie podroby, cielęcina, dziczyzna, indyk), ryby i owoce morza (śledzie, sardynki, pstrąg, małże), a także drożdże i niektóre rośliny strączkowe np. fasola, soczewica.
Umiarkowaną ilość puryn zawierają: kurczak, ostrygi, dorsz, szpinak [15].
Najniższą zawartością związków purynowych charakteryzują się:
- owoce (np. czereśnie, gruszki, jabłka, wiśnie, maliny, porzeczki, kiwi, truskawki, pomarańcze, brzoskwinie)
- warzywa (np. pomidory, sałata, cebula, rzodkiew, szparagi, dynia, kalafior, papryka, marchew)
- produkty mleczne (np. ser edamski, jogurt naturalny, ser twarogowy)
- orzechy (np. laskowe, ziemne, migdały) [14]
Białko
U pacjentów z zaburzonym metabolizmem puryn zaleca się często ograniczanie białka ogółem w diecie. Wysoką zawartość tych związków kojarzy się z produktami będącymi dobrym źródłem białka. Jednak nie wykazano dowodów na to, by większa podaż białka ogółem sprzyjała podwyższeniu stężenia kwasu moczowego w surowicy krwi. Potwierdzono dodatnią korelację między poziomem końcowego produktu rozpadu puryn w surowicy a obecnością mięsa i owoców morza w diecie. Ujemna zależność cechowała spożycie chudych produktów mlecznych.
Wyniki badań
Z kolei spożycia produktów roślinnych bogatych w puryny (np. groch, fasola, szpinak, grzyby, fasolka szparagowa, soczewica) nie powiązano z podwyższonym stężeniem kwasu moczowego we krwi [14,16,17].
Udowodniono natomiast wysoką efektywność dużej zawartości wiśni w diecie w leczeniu dny moczanowej oraz chorób z nią związanych. Związki fenolowe zawarte w tych owocach wydają się powodować rzadsze pojawianie się ostrych napadów dny, a spożywanie ich podczas napadu może redukować stan zapalny oraz zmniejszyć ból.
Z kolei antocyjany pozyskane z wiśni działają przeciwzapalnie oraz zmniejszają aktywność cyklooksygenazy. Obniżenie ryzyka zachorowania na dnę moczanową obserwowano także u osób spożywających regularnie oleje roślinne i ryby, bogate w kwasy tłuszczowe EPA i DHA [14].
Zalecenia
Głównymi zaleceniami w diecie ubogopurynowej jest:
- ograniczenie spożycia cukru i słodyczy
- spożywanie odpowiedniej ilości:
- warzyw i owoców
- mleka i przetworów mlecznych
- olejów roślinnych
- ryb
- wypijanie dużej ilości płynów
- dbałość o uzyskanie i utrzymanie prawidłowej masy ciała
- unikanie głodówek oraz szybkiego odchudzania
- wskazana jest natomiast umiarkowana aktywność fizyczna [14].
Metabolizm puryn i jego zaburzenia
Kwasy nukleinowe dostają się do przewodu pokarmowego człowieka z żywnością pod postacią nukleoprotein. Podczas procesów trawienia większość z nich ulga całkowitemu rozpadowi do jednostek budulcowych z udziałem enzymów proteolitycznych. Jedynie niewielki odsetek zostaje podzielony na odcinki o długości od kilkuset do około 1700 par zasad. Jednak nawet takie fragmenty migrują do komórek nabłonka jelitowego, kępek Peyera, limfocytów i komórek wątroby czy też śledziony [1,3,4].
W metabolizmie puryn bierze udział wiele substancji, m.in. nukleazy specyficzne dla RNA i DNA, nukleotydazy, alkaiczne i kwasowe fosfatazy hydrolizujące wiązania 3’- i 5’-NT, deaminazy AMP, fosforylazy purynowych nukleozydów, które hydrolizują nukleozydy do zasad. Adenozyna ulega deaminacji do inozyny dzięki deaminazie adenozynowej.
W końcowym etapie metabolizmu puryn powstaje kwas moczowy za pomocą oksydazy ksantynowej [3]. U ssaków poza wyższymi naczelnymi występuje urykaza, która rozkłada produkt przemiany związków purynowych do dobrze rozpuszczalnej w wodzie alantoiny, jednak w organizmie człowieka enzym ten nie jest obecny [2].
Produkty rozpadu nukleoprotein w przewodzie pokarmowym są częściowo przeznaczane do syntezy kwasów nukleinowych w organizmie człowieka, co stanowi dużą oszczędność energetyczną. Biosynteza 1 cząsteczki zasady azotowej wymaga nakładu 7 cząsteczek ATP, czyli około 49 kcal/mo.
Dna moczanowa
Najbardziej powszechnym zaburzeniem katabolizmu puryn jest skaza (dna) moczanowa. Nadprodukcja puryn może prowadzić do wysokiego stężenia kwasu moczowego w organizmie. Gdy stężenie moczany w surowicy przekracza granicę rozpuszczalności, tworzą się kryształy moczanu sodu. Odkładają się one w tkankach miękkich i stawach. Powodują stan zapalny zwany dnawym zapaleniem stawów.
Inne zaburzenia metabolizmu
Chorobami z przebiegającym zaburzeniem metabolizmu puryn są również m.in. zespół Lescha-Nyhana, niedobór deaminazy adenozynowej i fosforylazy nukleozydów purynowych [2]. Natomiast wrodzone wady metabolizmu puryn i pirymidyn (P/P) mogą sprzyjać poważnym dysfunkcjom wielu układów m.in. nerwowego, immunologiczne, hematologicznego oraz moczowego.
Dotychczas wykryto 30 defektów enzymatycznych szlaku puryn i pirymidyn, a 15 z nich ma znaczenie kliniczne. Defekty te występują bardzo rzadko w populacji. Ze względu na ich różnorodne objawy są często trudne do wykrycia. Wczesna diagnoza może zmniejszać śmiertelność oraz zapobiec niebezpiecznym powikłaniom. Wielu lekarzy nadal nie jest świadomych ich istnienia. Laboratoria często nie mają możliwości screeningu w ich kierunku [5].
Rola puryn w organizmie człowieka
Puryny pełnią funkcję prekursorów kwasów nukleinowych, ale także stanowią istotny element w metabolizmie energetycznym, regulacji aktywności enzymów, przekazywaniu sygnałów oraz syntezie białek. Łącząc się z witaminami oraz ich pochodnymi wchodzą w strukturę wielu koenzymów.
Biorą także udział w przenoszeniu energii w przemianach metabolicznych i fosforylacji oksydacyjnej. Natomiast w połączeniu z cukrami i lipidami nukleozydy pośredniczą w biosyntezie wielu składników.
Syntetyczne związki purynowe zawierają halogeny, triole lub dodatkowe atomu azotu. Hamują one działanie enzymów odpowiedzialnych za biosyntezę nukleotydów lub wbudowują się do DNA lub RNA. Dzięki temu odnajdują zastosowanie w chemioterapii nowotworów oraz leczeniu AIDS, a także w immunosupresji podczas transplantacji narządów [2].
Nukleotydy zawarte w żywności mogą działać korzystnie na wzrost i dojrzewanie kolonocytów. W badaniu in vitro wykazano, iż brak nukleotydów w diecie zmniejsza zdolność do reakcji immunologicznej przeciwko drobnoustrojom. Efektami zdrowotnymi spożywania wraz z pokarmem nukleotydów są także ochroną przeciwko biegunce, pozytywny wpływ na mikrobiotę kału oraz wzmacnianie odporności komórkowej [3].
W badaniu Cieślak i in. [6] wykazano, iż adenozyna i agoniści receptora A1 są obecne w komórkach β trzustki i tkanki tłuszczowej. Biorą one udział w obniżaniu wydzielania insuliny, a adenozyna pobudza także wydzielanie glukagonu. Związki te zmniejszają również poziom wolnych kwasów tłuszczowych i triglicerydów we krwi oraz zwiększają wrażliwość tkanek na insulinę.
Działanie neuroprotekcyjne
Puryny wykazują działanie neuroprotekcyjne, zarówno w przypadku uszkodzeń niedokrwiennych, drgawkowych, jak i spowodowanych ekscytotoksycznością. W każdym z tych stanów patologicznych przy towarzyszącym deficycie energetycznym następuje wzmożone uwalnianie pobudzających aminokwasów, w szczególności glutaminianu.
Dochodzi wtedy do nagłego wzrostu pozakomórkowego stężenia adenozyny, która działa przez receptory adenozynowe A1 i redukuje produkcję glutaminy, co jest elementem jej działania ochronnego. Podobne efekty obserwuje się w trakcie podawania inhibitorów enzymów, które ją rozkładają, czyli kinazy i deaminazy adenozyny, a także podczas wychwytu zwrotnego adenozyny, gdyż zwiększa to pozakomórkowy poziom tej puryny w mózgu.
Receptory adenozynowe A2 wydają się mieć istotne znaczenie w przewlekłych chorobach neurodegeneracyjnych (choroba Parkinsona i Hungtintona). Dowiedziono, iż inaktywacja receptorów adenozynowych A2A zmniejsza stopień uszkodzeń wywołanych podaniem MPTP czy też 6-hydroksydopaminy.
Antagoniści receptorów ADA łagodzą objawy chorobowe oraz działają ochronnie w zwierzęcych modelach choroby Parkinsona. Wysuwa się hipotezę, iż powyższe związki mogą poprawiać funkcje motoryczne u pacjentów, ale także spowalniać rozwój choroby [7]. Adenozyna pełni również funkcję neurotransmitera i neuromodulatora w centralnym układzie nerwowym. Reguluje ona wydzielanie neuroprzekaźników z udziałem receptorów adenozynowych A1, ale także A2, A2B oraz A3.
Bierze także udział w przekazywaniu sygnału nerwowego, ochronie komórek nerwowych w sytuacjach stresowych oraz uczestniczy w procesach proliferacji i apoptozy komórek wielu typów [8].
Zaburzenia w układzie purynergicznym zaobserwowano w chorobach neuropsychiastrycznych. W badaniu Salvadore i in. [9] odkryto, że u osób z pierwszym epizodem manii występuje wzrost stężenia kwasu moczowego. Może to sugerować, iż zaburzenia układu purynergicznego pojawia się we wczesnym etapie choroby afektywnej dwubiegunowej (ChAD).
Z kolei w pracy Bartoli i in. [10,11] wykazano, że chorych z ChAD charakteryzuje podwyższone stężenie końcowego produktu metabolizmu puryn w porównaniu ze zdrowymi osobami oraz pacjentów z depresją. W kolejnej analizie [12] wskazano, iż u osób z pierwszym epizodem manii poziom kwasu moczowego jest znacząco wyższy niż u osób z grupy kontrolnej oraz obniża się wraz z poprawą stanu klinicznego w ciągu miesięcznej terapii.
W pracy porównującej stężenie kwasu moczowego u chorych z ChAD w okresie epizodu maniakalnego i depresyjnego oraz remisji nie wykazano różnic między fazami schorzenia. Natomiast zdiagnozowano hiperurykemię u 1/3 pacjentów przechodzących epizod depresyjny. Zatem zaburzenia metabolizmu puryn mają znaczenie w zdrowiu psychicznym człowieka [13].
Podsumowanie
Puryny mają istotne znaczenie w funkcjonowaniu organizmu ludzkiego, jednak ich podaż w diecie nie jest kluczowa u osób zdrowych. Natomiast osoby z zaburzeniami metabolizmu puryn powinny ograniczać ich spożycie w diecie.
Piśmiennictwo
- J. Głazowska, U. Stankiewicz, A. Bartoszek. Absorpcja, metabolizm i rola biologiczna kwasów nukleinowych obecnych w żywności. ŻYWNOŚĆ. Nauka. Technologia, Jakość, (2017); 1(110):18-32
- R.T. Smoleński (red.). Biochemia Harpera Ilustrowana, VII, (2018), PZWL, Warszawa
- J. Głazowska, U. Stankiewicz, R. Tylingo, A. Bartoszek. Kwasy nukleinowe w żywności – występowanie i właściwości reologiczne. ŻYWNOŚĆ. Nauka. Technologia, Jakość, (2016); 6(109):5-19
- M. Palka-Santini, B. Schwarz-Herzke, M. Hösel, D. Renz, S. Auerochs, H. Brondke, W. Doerfler. The gastrointestinal tract as the portal of entry for foreign macromolecules: fate of DNA and proteins. Mol. Gen. Genomics, (2003); 3(270),201-215
- A. Jurecka, A. Tylki-Szymańska. Wrodzone wady metabolizmy na szlaku puryn i pirymidyn. Pediatria Polska, (2009); 84(2):121-133
- M. Cieślak, M. Cieślak. Rola puryn i cytokin prozapalnych w cukrzycy. Diabetologia Praktyczna, (2017); 3(3):99-111
- J. Wardas. Neuroprotekcyjna rola adenozyny. Neuroprotekcja. XX Zimowa Szkoła Instytutu Farmakologii PAN, Mogilany, (2003): 143-167
- M. Romanowska, M. Komoszyński. Adenozyna – neuroprzekaźnik i neuromodulator w centralnym układzie nerwowym. Postępy Biochemii, (2002); 48(3):230-238
- G. Salvadore i in. Increased uric acid levels in drug-naive subjects with bipolar disorder during a first manic episode. Prog. Neuropsychopharmacol. Biol. Psychiatry, (2010); 34(6): 819–821
- F. Bartoli, C. Crocamo, M.G. Mazza, M. Clerici, G. Carrà. Uric acid levels in subjects with bipolar disorder: A comparative meta-analysis. J. Psychiatr. Res., (2016); 81: 133–139
- F. Bartoli i in. Purinergic system dysfunctions in subjects with bipolar disorder: A comparative cross-sectional study. Compr. Psychiatry, (2017); 73: 1–6
- S.S. Chatterjee, S. Ghosal, S. Mitra, N. Mallik, M.K. Ghosal. Serum uric acid levels in first episode mania, effect on clinical presentation and treatment response: Data from a case control study. Asian J. Psychiatr., (2018); 35: 15–17
- M. Malewska, A. Permoda-Osip, P. Kasprzak, A. Niemiec, J. Rybakowski . A study of uric acid concentration in bipolar disorder and schizophrenia. Farmakoterapia w Psychiatrii i Neurologii, (2017); 33(3–4): 185-187
- L. Kozłowska. Hiperurykemia i dna moczanowa. [W:] D. Włodarek, E. Lange, L. Kozłowska, D. Głąbska. Dietoterapia. Wydawnictwo Lekarskie PZWL, Warszawa, (2015)
- M. Grzymisławski, J. Gawęcki (red). Żywienie człowieka zdrowego i chorego. PWN, Warszawa, (2012)
- H.K. Choi, K. Atkinson, W.E. Karlson, W. Willett. G. Curhan. Purine-Rich Foods, Dairy and Protein Intake, and the Risk of Gout in Men. N Engl J Med, (2004); 350:1093-103
- R. Villegas i in. Purine-rich foods, protein intake, and the prevalence of hyperuricemia: the Shanghai Men’s Health Study. Nutr. Metab. Cardiovasc. Dis., (2011); 22: 409-416