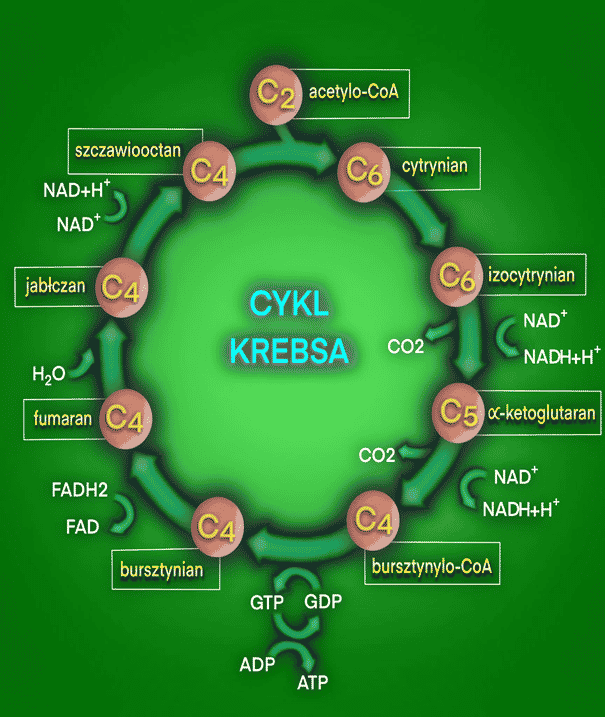
Cykl Krebsa jest cyklem reakcji biochemicznych. Stanowi jeden z etapów oddychania komórkowego. Oddychanie komórkowe to podstawowy proces, który dostarcza komórkom energii i podtrzymuje życie. W jego wyniku związki organiczne są rozkładane do związków prostych z wydzieleniem energii. Część energii jest magazynowana w postaci ATP (adenozyno-5’-difosforanu). Jest to związek stanowiący źródło energii w wielu procesach fizjologicznych. Najczęstszym związkiem, który jest wykorzystywany do oddychania komórkowego, jest glukoza. Rzadziej organizm wykorzystuje inne cukry, tłuszcze czy białka. (1, 2, 3)
Na oddychanie komórkowe składają się trzy etapy: glikoliza, cykl Krebsa oraz łańcuch oddechowy. W wyniku cyklu Krebsa powstaje jedna cząsteczka ATP, dwie cząsteczki CO2, trzy cząsteczki NADH + H+ (dinukleotyd nikotynoamidoadeninowy w formie zredukowanej) oraz jedna cząsteczka FADH2 (dinukleotyd flawinoadeninowy w formie zredukowanej). (1, 2, 3)
Nazwa cykl Krebsa pochodzi od nazwiska uczonego Hansa Adolfa Krebsa. Przedstawił on kluczowe elementy cyklu w 1937 r. W 1953 r. otrzymał za to nagrodę Nobla z dziedziny fizjologii i medycyny. Inna nazwa cyklu Krebsa to cykl kwasu cytrynowego. Nazwa ta pochodzi od pierwszego substratu cyklu przemian – cytrynianiu. Możemy również spotkać nazwę cykl kwasów trikarboksylowych. Kwasy trikarboksylowe to związki organiczne, które ulegają przemianom w cyklu Krebsa pod wpływem działania enzymów. (4)
Gdzie przebiega cykl Krebsa?
Cykl Krebsa odbywa się w macierzy mitochondrium. (5) Mitochondria to organella otoczone dwoma błonami. Znajdują się w komórkach żywych organizmów. Nazywane są centrum energetycznym komórki. W mitochondriach zachodzą dwa etapy oddychania komórkowego. Oprócz cyklu Krebsa, także następujący po nim łańcuch oddechowy. W wyniku tych procesów powstaje dużo energii potrzebnej do podtrzymywania procesów życiowych. Energia ta jest wytwarzana w postaci ATP. Macierz mitochondrium to przestrzeń wewnątrz mitochondrium. Jest wypełniona substancją płynną, w której znajdują się enzymy. Dzięki nim w mitochondrium zachodzi wiele ważnych reakcji biochemicznych. (6, 8)
Mitochondria są związane z utrzymywaniem stanu równowagi w komórce – homeostazy. Odgrywają ważną rolę w metabolizmie aminokwasów, lipidów, cholesterolu, sterydów i nukleotydów. W mitochondriach hepatocytów (komórek wątroby) zachodzi cykl mocznikowy. W jego wyniku powstaje mocznik, który jest wydalany z naszego organizmu przede wszystkim z moczem. Dzięki temu z organizmu usuwany jest nadmiar azotu.
Mitochondria biorą także udział w sygnalizacji wewnątrzkomórkowej i procesie apoptozy. (6, 7) Apoptoza to jeden z typów programowanej śmierci komórki. Programowana śmierć komórki to ściśle kontrolowany proces. Pozwala na usunięcie z organizmu komórek uszkodzonych, zmutowanych, zbędnych i zakażonych. Pomaga zachować homeostazę organizmu. Na drodze apoptozy z organizmu zostają usunięte nieprawidłowe komórki np. nowotworowe. Dzięki temu nie dochodzi do rozwoju choroby nowotworowej. (9)
Rola w metabolizmie
Cykl Krebsa jest ostatnim etapem utleniania dla większości węglowodanów, tłuszczy oraz aminokwasów. Pierwszy substrat cyklu – cytrynian – powstaje z acetyloCoA (acetylokoenzymu A). Cząsteczka ta pochodzi z rozkładu węglowodanów i kwasów tłuszczowych. Cykl Krebsa jest kluczowy w dostarczaniu organizmowi energii. Łączy ze sobą większość szlaków metabolicznych istniejących w naszym organizmie. W trakcie cyklu Krebsa powstają prekursory wielu metabolitów pośrednich. Metabolity te mogą być zarówno związkami rozpoczynającymi szlaki anaboliczne, jak i końcowymi związkami szlaków katabolicznych.
W wyniku reakcji anabolicznych z prostych związków powstają bardziej złożone. Katabolizm jest przeciwieństwem anabolizmu. W wyniku reakcji katabolicznych ze złożonych związków powstają proste. (4, 10)
Do cyklu Krebsa mogą być włączane aminokwasy po deaminacji. Aminokwasy to cząsteczki budujące białka. Aminokwasy są zbudowane z grupy aminowej (-NH2) oraz karboksylowej (-COOH), które są połączone szkieletem węglowym. Deaminacja polega na odłączeniu od aminokwasu grupy aminowej.
Metabolity pośrednie cyklu Krebsa mogą też być substratami w glukoneogenezie.
Glukoneogeneza to proces przekształcania niecukrowych substratów w glukozę. Metabolity pośrednie cyklu Krebsa mogą być też substratami do produkcji kwasów tłuszczowych, aminokwasów białkowych czy hemu. (10) Hem jest czerwono-brązowym barwnikiem krwi i stanowi składnik hemoglobiny. Hemoglobina jest białkiem znajdującym się w czerwonych krwinkach. Umożliwia krwinkom transportować tlen. (11)
Etapy cyklu Krebsa
Pierwszym etapem cyklu Krebsa jest kondensacja acetylo-CoA i szczawiooctanu. Acetylo-CoA jest związkiem dwuwęglowym. Oznacza to, że w jednej cząsteczce acetylo-CoA znajdziemy dwa atomy węgla. Analogicznie szczawiooctan jest związkiem czterowęglowym. Kondensacja acetylo-CoA i szczawiooctanu skutkuje powstaniem sześciowęglowego cytrynianu. Cytrynian jest uznawany za pierwszy substrat cyklu Krebsa. Proces zachodzi pod wpływem działania enzymu – syntazy cytrynianowej. Enzym ten w komórkach eukariontów znajduje się w błonie wewnętrznej mitochondriów. (4, 10) W komórkach organizmów eukariotycznych znajduje się jądro komórkowe, co odróżnia je od organizmów prokariotycznych. Do organizmów eukariotycznych zaliczamy wszystkie organizmy komórkowe oprócz bakterii i archeonów.
Następnie cytrynian jest przekształcany do cis-akonitanu. Reakcja zachodzi na skutek odłączenia cząsteczki wody od cytrynianu pod wpływem enzymu akonitazy. Cis-akonitan jest produktem pośrednim. Kolejnym etapem jest ponowne przyłączenie cząsteczki wody do cis-akonitanu pod wpływem działania akonitazy. Jednak grupa hydroksylowa (-OH) przyłącza się do drugiego atomu węgla w cząsteczce. W przypadku cytrynianu znajdziemy ją przy węglu trzecim. W ten sposób powstaje izomer cytrynianu – izocytrynian (sześciowęglowy). Izomery to związki chemiczne, które mają taki sam wzór sumaryczny. Różnią się rodzajem, kolejnością i rozmieszczeniem wiązań oraz atomów w cząsteczce. (10, 12)
Kolejnym etapem jest utlenienie izocytrynianu przy użyciu NAD+ do szczawiobursztynianu. Grupa hydroksylowa zostaje przekształcona w karbonylową. Reakcja ta zachodzi pod wpływem enzymu dehydrogenazy izocytrynianowej. Następnie enzym przeprowadza jeszcze dekarbokyslację szczawiobursztynianu. Oznacza to, że usuwana jest z niego grupa karboksylowa (-COOH). Ten etap kończy się powstaniem alfa-ketoglutaranu, CO2 i NADH + H+. (10) NADH + H+ jest niezbędny do zajścia kolejnego etapu oddychania komórkowego, który następuje po cyklu Krebsa. Jest nim łańcuch oddechowy.
Alfa-ketoglutaran jest następnie przekształcany do bursztynylo-CoA (czterowęglowy). Alfa-ketoglutaran ulega oksydacyjnej dekarboksylacji. Proces zachodzi pod wpływem kompleksu dehydrogenazy alfa-ketoglutaranowej. Jest to kompleks enzymatyczny zbudowany z trzech enzymów. W wyniku reakcji powstaje także cząsteczka NADH + H+ (również przydatna w łańcuchu oddechowym) oraz CO2. (10)
Następnie zachodzi reakcja fosforylacji substratowej. W jej wyniku bursztynylo-CoA przekształca się w bursztynian (czterowęglowy). Reakcja zachodzi pod wpływem enzymu tiokinazy bursztynianowej. W wyniku reakcji powstaje także ATP. (4, 10)
Bursztynian jest następnie przekształcany w fumaran (czterowęglowy). Ulega odwodornieniu pod wpływem działania enzymu – dehydrogenazy bursztynianowej. Wynikiem reakcji jest także redukcja FAD do FADH2. Jest on potrzebny do zajścia łańcucha oddechowego. (10, 13)
Następnie do fumaranu jest przyłączana cząsteczka wody. Dzieje się tak pod wpływem enzymu fumarazy (hydratazy fumaranowej). W wyniku reakcji powstaje jabłczan (czterowęglowy) i zachodzi redukcja NAD+ do NADH + H+. NADH + H+ jest wykorzystywany w łańcuchu oddechowym. (10, 14)
W ostatniej reakcji cyklu Krebsa z jabłczanu usuwana jest cząsteczka wody. Reakcja dehydratacji jabłczanu zachodzi pod wpływem enzymu dehydrogenazy jabłczanowej. NAD+ ulega redukcji do NADH + H+, który jest później wykorzystywany w łańcuchu oddechowych. Z jabłczanu powstaje szczawiooctan, Szczawiooctan może dalej reagować z acetylo-CoA, dzięki czemu powstanie cytrynian. W ten sposób cykl zaczyna się od nowa. (10)
Dieta a cykl Krebsa
Czym są sirtuiny?
Na cykl Krebsa wpływają także sirtuiny. Sirtuiny to rodzina siedmiu enzymów (sirtuina 1-7). Uczestniczą one w regulacji wielu procesów metabolicznych. Sirtuiny spełniają różne funkcje, niektóre nawet wzajemnie antagonistyczne. Na aktywność sirtuin wpływa dostępność NAD+ (dinukleotyd nikotynoamidoadeninowy w formie utlenionej). W mitochondriach dominują sirtuina 3, sirtuina 4 i sirtuina 5. Sirtuiny biorą udział w potranslacyjnej modyfikacji białek. Dzięki temu wpływają na wiele procesów komórkowych w tym metabolizm glukozy i lipidów, kancerogenezę, apoptozę, naprawę DNA czy starzenie komórek. (15, 16, 17)
Wpływ sirtuin na cykl Krebsa
Sirtuiny wpływają na tempo procesów metabolicznych w komórkach, w tym na cykl Krebsa. Z uwagi na budowę sirtuiny 5 możliwe jest odcinanie od niej m.in. grupy sukcynylowej. Związkiem istotnym dla metabolizmu, który posiada grupę sukcynylową jest bursztynylo-CoA. Jest on metabolitem pośrednim cyklu Krebsa i może być włączony do cyklu. (15, 18)
Sirtuina 4 ogranicza wydzielanie insuliny, ponieważ hamuje działanie enzymu dehydrogenazy glutaminianowej (GDH). Enzym ten katalizuje odwracalną reakcję przekształcania glutaminianu do alfa-ketoglutaranu, który jest włączany do cyklu Krebsa. Zahamowanie działania GDH zmniejsza dostępność metabolitów pośrednich cyklu Krebsa. W związku z tym w komórce znajduje się mniej ATP. Skutkuje to zmniejszeniem wydzielania insuliny. Sirtuina 4 hamuje także aktywność kompleksu enzymatycznego dehydrogenazy pirogronianowej (PDH). PDH przekształca pirogronian w acetylo-CoA. Pirogronian jest produktem glikolizy – pierwszego etapu oddychania komórkowego. Dzięki aktywności PDH acetylo-CoA może zostać wykorzystany w cyklu Krebsa. Wynika z tego, że sirtuiny mają wpływ na cykl Krebsa. (15)
Co wpływa na aktywność sirtuin?
Aktywność sirtuin zwiększa się podczas wysiłku fizycznego. Sugeruje się, że także restrykcja kaloryczna może zwiększać ich aktywność. (15, 19) Jednak nie należy ograniczać kalorii na własną rękę. Najlepiej skonsultować to z dietetykiem.
Oczywiście zbyt duże spożycie składników energetycznych takich jak węglowodany i tłuszcze hamuje ekspresję i aktywność sirtuin. Naukowcy badali wpływ diety wysokotłuszczowej na ekspresję sirtuin u zwierząt. Zaobserwowali obniżenie aktywności sirtuin i równoczesny rozwój nietolerancji glukozy. (20) Warto wiedzieć, że według oficjalnych zaleceń IŻŻ tłuszcz nie powinien dostarczać więcej niż 30% energii z diety. (23) Co ciekawe u pacjentów z niealkoholowym stłuszczeniem wątroby wykryto obniżoną aktywność sirtuin. (21) Sugeruje się, że kwasy tłuszczowe omega-3 mogą przeciwdziałać obniżonej ekspresji sirtuin. (22) Zbyt duża ilość węglowodanów w diecie również obniża ekspresję sirtuin. (24) Węglowodany w diecie powinny dostarczać 45-65% energii. (23)
Aktywność sirtuin jest stymulowana przez polifenole. Polifenole to związki organiczne. Są wtórnymi metabolitami roślin. Najbardziej znanym polifenolem jest resweratrol.
Głównymi źródłami resweratrolu w diecie są winogrona, orzeszki ziemne, soja, jagody, borówki, żurawina i kakao. (25, 26, 27) Polifenole znajdziemy także w herbacie, kawie, wiśniach i owocach cytrusowych. Do warzyw bogatych w polifenole zaliczamy karczochy, oliwki, szpinak i fasolę. (28) Zadbanie o dietę stymulującą aktywność sirtuin poprawi wydajność cyklu Krebsa. Przyspieszy więc wiele przemian metabolicznych, zachodzących w naszym organizmie.

Zaburzenia cyklu Krebsa
Rola tiaminy
Tiamina (witamina B1) jest niezbędna do prawidłowego przebiegu cyklu Krebsa. Tiamina musi być dostarczana z pożywieniem. (29) Najwięcej tiaminy znajdziemy w soczewicy czerwonej, nasionach słonecznika, zarodkach pszennych i drożdżach. Do produktów bogatych w tiaminę należą także schab wieprzowy, kasza gryczana, kasza jaglana, fasola biała, groch, soja i otręby pszenne. (30)
Tiamina może występować w komórkach w postaci wolnej oraz estrów fosforanowych (mono-, piro i trifosforanu). Pirofosforan tiaminy (TPP) jest niezbędny do aktywności dehydrogenazy pirogronianowej. (PDH) (29) Dehydrogenaza pirogronianowa (PDH) jak wspomniano wcześniej przekształca pirogronian w acetylo-CoA. Dzięki temu acetylo-CoA może ulec przemianie do cytrynianu po kondensacji ze szczawiooctanem. (15)
Podsumowując, TPP pośrednio dostarcza substratu do cyklu Krebsa. TPP jest również niezbędny do aktywności dehydrogenazy alfa-ketoglutaranowej. (29) Enzym ten bierze udział w cyklu Krebsa. Przekształca alfa-ketoglutaran w bursztynylo-CoA. (10) Obniżona aktywność enzymów skutkuje mniejszą ilością energii wytwarzaną w komórkach.
Choroba beri-beri
Z aktywnością enzymów cyklu Krebsa wiąże się choroba beri-beri. Choroba ta jest spowodowana niedoborem tiaminy. Choroba beri-beri występuje w trzech postaciach: tzw. mokrej, suchej i piorunującej (zespół Shoshina).
Postać mokra objawia się zaburzeniami sercowo-naczyniowymi, nadciśnieniem tętniczym i obrzękami obwodowymi. Postać sucha skutkuje uszkodzeniem nerwów obwodowych. Pacjenci mają zarówno problemy z poruszaniem się, jak i z czuciem. Ta postać choroby może prowadzić do paraliżu. Natomiast zespół Shoshina skutkuje ostrą niewydolnością układu krążenia połączoną z niewydolnością płuc. (29, 31)
Metale ciężkie
Zatrucie metalami ciężkimi może skutkować upośledzeniem funkcji dehydrogenazy pirogronianowej. Negatywny wpływ na aktywność PDH ma arsen, miedź i rtęć. Zatrucie tymi metalami prowadzi do zaburzeń neurologicznych podobnych jak w przypadku choroby beri-beri. (31, 32, 33)
Podsumowanie
Cykl Krebsa jest bardzo ważnym szlakiem biochemicznym. Pozwala na wytwarzanie energii podtrzymującej życie. Możemy wspomóc jego wydajność poprzez regularne ćwiczenia i odpowiedni rozkład makroskładników diety. Warto także włączyć do diety pokarmy bogate w polifenole oraz tiaminę.

Bibliografia:
- Miller, S. L., Smith-Magowan, D. (1990). The Thermodynamics of the Krebs Cycle and Related Compounds, J. Phys. Chem. Ref. Data., 19(4), 1049-1073
- Borowicz, K. K. (2013). Aspekty biochemiczne i patofizjologiczne aktywności fizycznej, Zeszyty Naukowe WSSP, 17, 137-148
- http://www.tridea.pl/attachments/article/6/art.%20popiningisa.pdf
- Kumar, P., & Dubey, K. K. (2019). Citric Acid Cycle Regulation: Back Bone for Secondary Metabolite Production, New and Future Developments in Microbial Biotechnology and Bioengineering, 2019, 165–181
- https://ug.edu.pl/sites/default/files/postepowania_naukowe/47281/streszczenie/wieczorek_streszczenie_0.pdf
- Chinnery, P. F., Schon, E. A. (2003). Mitochondria, J Neurol Neurosurg Psychiatry., 2003, 1188-1199
- Matsumoto, S., Haberle, J., Kido, J., Mitsubuchi, H., Endo, F., Nakamura, K. (2019). Urea cycle disorders—update, Journal of Human Genetics, 64, 833–847
- Wojtczak, L. (1964). Niektóre zagadnienia struktury i funkcji mitochondriów, Postępy Biochemii, 10(1), 43-54
- Rudnicka, K. W., Szczęsna, E., Miszczyk, E., Mikołajczyk-Chmiela, M. (2011). Apoptoza i autofafia – mechanizmy i metody detekcji, Postępy biologii komórki, 38(2), 247-265
- Akram, M. (2014). Citric Acid Cycle and Role of its Intermediates in Metabolism, Cell Biochem Biophys., 68, 475–478
- Dietz, E. M. (1935). Chlorophyll and hemoglobin – two natural pyrrole pigments, J. Chem. Educ., 12(5), 208-216
- Costello, L. C., Franklin, R. B. (1981). Aconitase Activity, Citrate Oxidation, and Zinc Inhibition in Rat Ventral Prostate, Enzyme, 26(6), 281–287
- Briere, J. J., Favier, J., Ghouzzi, V. E., Djouadi, F., Benit, P., Gimenez, A. P., Rustin, P. (2005). Succinate dehydrogenase deficiency in human, Cell. Mol. Life Sci. 62, 1-8
- Akiba, T., Hiraga, K., Tuboi, S. (1984). Intracellular Distribution of Fumarase in Various Animals, J. Biochem., 96, 189-195
- Frydzińska, Z., Owczarek, A., Winiarska, K. (2019). Sirtuiny i ich rola w regulacji metabolizmu, Postępy Biochemii, 65(1), 31-40
- Ye, X., Li, M., Hou, T., Gao, T., Zhu, W., Yang, Y. (2017). Sirtuins in glucose and lipid metabolism, Oncotarget, 8(1), 1845-1859
- Mei, Z., Zhang, X., Yi, J., Huang, J., He, J., Tao, Y. (2016). Sirtuins in metabolism, DNA repair and cancer, Journal of Experimental & Clinical Cancer Research, 35(182), 1-14
- Du J (2011). Sirt5 is an NAD-dependent protein lysine demalonylase and desuccinylase, Science 334, 806-809
- Wiercińska, M., Rosołowska-Huszcz, D. (2017). Naturalne i syntetyczne modulatory aktywności sirtuin, Kosmos, 66(3), 365-377
- Drew J. E., Farquharson A. J., Horgan G. W., Williams L. M. (2016) Tissue-specific regulation of sirtuin and nicotinamide adenine dinucleotide biosynthetic pathways identified in C57Bl/6 mice in response to high-fat feeding, J. Nutr. Biochem. 37, 20-29
- T., Liu Y. H., Fu Y. C., Liu X. M., Zhou X. H. (2014). Direct evidence of sirtuin downregulation in the liver of non-alcoholic fatty liver disease patients, Ann. Clin. Lab. Sci., 44, 410-418
- Luo X., Jia R., Yao Q., Xu Y., Luo Z., Luo X., Wang N. (2016) Docosahexaenoic acid attenuates adipose tissue angiogenesis and insulin resistance in high fat diet-fed middle-aged mice via a sirt1-dependent mechanism, Mol. Nutr. Food Res., 60, 871-885
- https://ncez.pzh.gov.pl/wp-content/uploads/2021/03/normy_zywienia_2020web.pdf
- https://www.nature.com/articles/srep16774
- Ashihara, H. (2002). Plant Foods and Herbal Sources of Resveratrol, Agric. Food Chem., 50, 3337−3340
- Tian, B., Liu, J. (2020). Resveratrol: A review of plant sources, synthesis, stability, modification and food application, Journal of the Science of Food and Agriculture, 2020, 1-27
- Counet, C., Callemien, D., Collin, S. (2006). Chocolate and cocoa: New sources of trans-resveratrol and trans-piceid, Food Chemistry, 98, 649–657
- Godos, J., Marventano, S., Mistretta, A., Galvano, F., Grosso, G. (2017). Dietary sources of polyphenols in the Mediterranean healthy Eating, Aging and Lifestyle (MEAL) study cohort, International Journal Of Food Sciences And Nutrition, 2017, 1-8
- Tylicki, A., Siemieniuk, M. (2011). Tiamina i jej pochodne w regulacji metabolizmu komórek, Postepy Hig Med Dosw., 65, 447-469
- https://www.wapteka.pl/blog/artykul/witamina-b1-tiamina-do-czego-jest-potrzebna-jakie-sa-objawy-niedoboru-i-nadmiaru-witaminy-b1
- Imamura, T., Kinugawa, K. (2015). Shoshin Beriberi With Low Cardiac Output and Hemodynamic Deterioration Treated Dramatically by Thiamine Administration, Int Heart J., 2015, 1-3
- Donaldson, M. L., Gubler, C. J. (1978). Biochemical effects of mercury poisoning in rats, The American Journal of Clinical Nutrition, 31(5), 859–864
- Blass, J. P., Lewis, C. A. (1973). Kinetic Properties of the Partially Purified Pyruvate Dehydrogenase Complex of Ox Brain, Biochem. J., 131, 31-37