W ostatnim czasie coraz częściej słyszy się o przewlekłym zmęczeniu. Wielokrotnie stwierdza się choroby przewlekłe, które ciężko wyleczyć. Wiele osób skarży się na migrenę, jelito drażliwe, alergie, ciągły brak energii. Często stawiane są diagnozy, które nie odzwierciedlają prawdziwego stanu pacjenta.
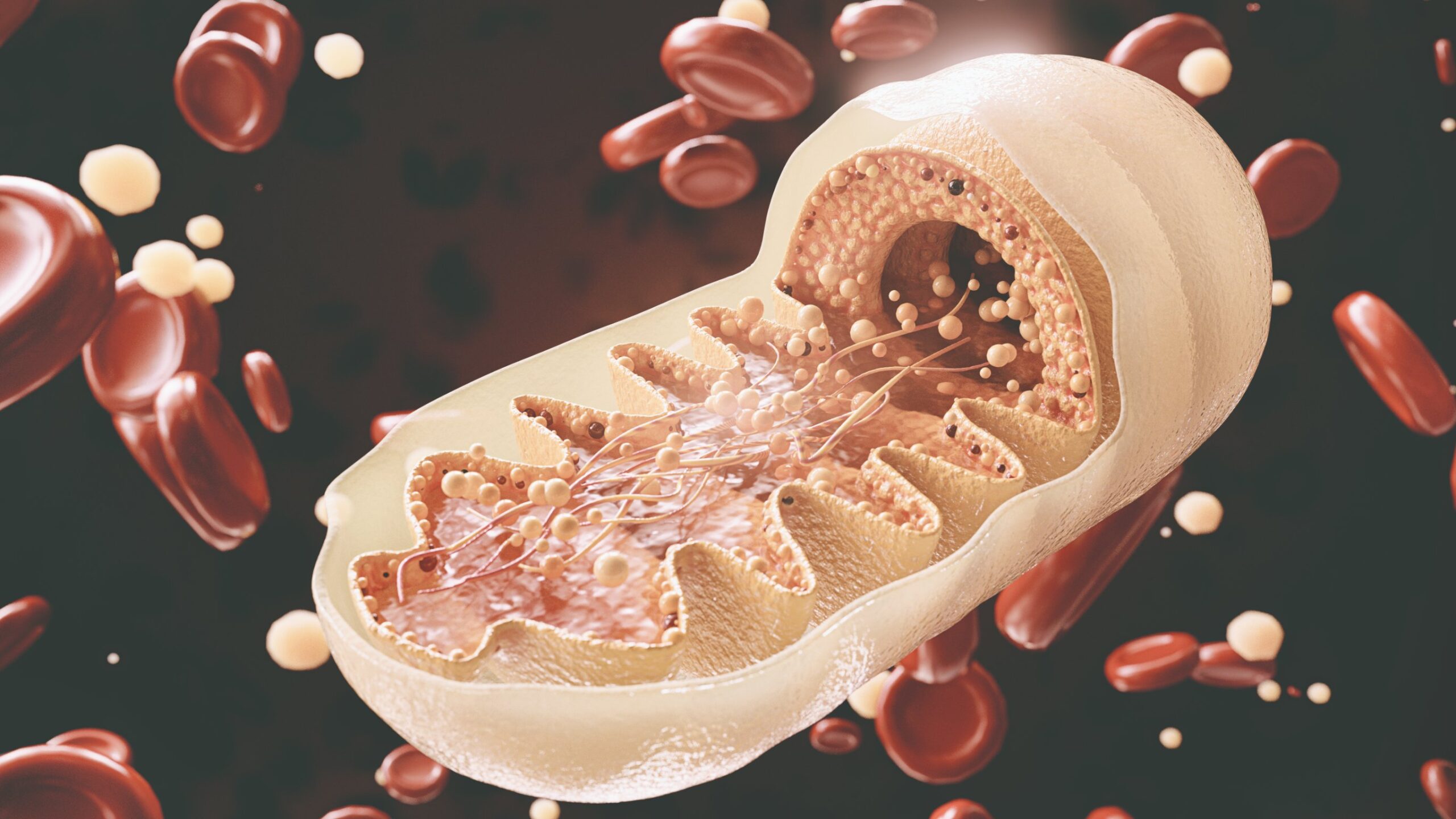
Większość osób nie wie, że za takie symptomy może odpowiadać zaburzona praca mitochondriów. To organelle komórkowe, które odpowiadają za przekształcenie tlenu i składników odżywczych w energię. Zaburzenie to powoduje dysfunkcje w wytwarzaniu energii w organizmie.
Spis treści:
- Czym jest mitochondriopatia?
- Funkcje mitochondriów
- Rodzaje mitochondriopatii
- Przyczyny
- Diagnostyka
- Terapia i dieta
- Podsumowanie
- Bibliografia
Czym jest mitochondriopatia?
Wyróżnić można mitochondriopatie pierwotne i wtórne [1]. Pierwotne, czyli wrodzone, dziedziczone są w sposób niezależny od otoczenia. Wykrywane są zazwyczaj zaraz po urodzeniu. Wtórne, tworzą się w wyniku działania czynników zewnętrznych. Do tych czynników należą np.: stres, niedobory mikroelementów, infekcje. Zaburzenie to może dotyczyć każdego narządu. Mitochondria doznają wtedy uszkodzeń z powodu toczącego się stanu zapalnego w organizmie. A to później przekłada się na ich pracę, prowadząc do zaburzenia w wytwarzaniu energii [1,17].
Nieprawidłowe funkcjonowanie mitochondriów może przyczynić się do zaburzenia funkcjonowania całego organizmu. Dochodzi do powstania wielu różnych, niespecyficznych schorzeń, które często błędnie są diagnozowane.
Funkcje mitochondriów
Mitochondria to małe organelle, znajdujące się w każdej komórce ciała. Wyjątek jednak stanowią czerwone krwinki. Za najważniejszą ich funkcje uznaje się produkcję energii (ATP). W komórkach mieści się od kilkuset do tysiąca mitochondriów. Ich ilość zależy od zapotrzebowania danego organu na energię [1]. Dla przykładu serce jest to narząd pracujący bez przerwy, więc wymaga sporo energii. W kardiomiocytach mitochondria mogą stanowić nawet 36% masy tych komórek [1].
Jedna z hipotez dotycząca mitochondriów głosi, że mogły wyewoluować z bakterii. Z uwagi na wiele wspólnych cech np.: wielkość, struktura [1,16]. Teoria endosymbiozy mówi o tym, że pewne organelle komórkowe, w tym mitochondria wywodzą się z bakterii. Powstała na skutek teorii o wniknięciu prokarioty (organizmu nieposiadającego jądra komórkowego) do eukarioty (organizmu z jądrem komórkowym). Została dobrze poznana i szacuje się, że zaczęła się ok. 1,5 mld lat temu. Powiązana była ze wzrostem tlenu w atmosferze [16]. Dzięki tej ewolucji mitochondria zyskały m.in.: strukturę przypominającą grzebień i szlaki biochemiczne. Należą do nich szlak glikolityczny (dzięki któremu powstaje energia) oraz synteza lipidów. Zbudowane są z zewnątrz z gładkiej, a z wewnątrz z pofałdowanej błony mitochondrialnej (membrany).
Dodatkowo zawierają matrycę oraz przestrzeń międzybłonową. Identyczne występują u baterii Gram-dodatnich [16]. Jest to rodzaj bakterii barwiących się na fioletowo metodą Gramma. Mitochondria zawierają tak jak bakterie koliste, DNA. Ulegają też podziałom poprzez rozszczepienie [16].
Mitochondria posiadają swój własny materiał genetyczny, znajdujący się w ich wnętrzu (macierzy). DNA umieszczone jest w macierzy, czyli płynnej substancji wypełniającej mitochondrium. Leży swobodnie, bez żadnej ochrony, dlatego niestety jest podatne na uszkodzenia. A zdolności regeneracyjne mitochondriów są ograniczone, stąd częściej stwierdza się w nich mutacje [1].
Rodzaje mitochondriopatii – podział na pierwotne i wtórne
Mitochondriopatie to schorzenia występujące wskutek zaburzonego funkcjonowania mitochondriów [1,15]. Następuje to w wyniku uszkodzenia DNA mitochondriów. Dzieli się je na pierwotne oraz wtórne.
Pierwotne
Powstają na skutek dziedziczonych mutacji genetycznych w mitochondriach. Zaburzenia tworzą się w sposób niezależny od czynników zewnętrznych [1].
Najczęściej dotyczą organów, które mają większe zapotrzebowanie na energię: np. tkanki mięśniowej. Trzeba wspomnieć, że materiał genetyczny z mitochondrium dziedziczy się od matki [1]. Dlatego kobiety szczególnie powinny zadbać o siebie już przed okresem ciąży.
Do pierwotnych mitochondriopatii należą m.in.: zespół Leigha, MELAS oraz MERRF [3]. Niedawno odkryto dziedziczną kanalikowo-śródmiąższową chorobę nerek, powstającą w wyniku mutacji DNA mitochondriów. Schorzenie to obejmuje tylko jeden narząd. U wszystkich pacjentów z niewydolnością nerek powinno zbadać się mitochondria metodą mikroskopii elektronowej. Może znacząco wpłynąć na zmianę leczenia [2].
Wtórne
Mitochondriopatie wtórne powstają w wyniku działania czynników środowiskowych. Do tych czynników należą: stres, ekspozycja na metale ciężkie, pestycydy, zła dieta itp. Charakteryzują się zmniejszoną syntezą mitochondriów, a przez to zaburzeniami w wytwarzaniu energii [15].
Organelle te odpowiadają za liczne procesy m.in. za oddychanie komórkowe. W wyniku tego powstaje nie tylko energia, ale również wolne rodniki tlenowe. Pomimo posiadania zdolności antyoksydacyjnych, mitochondria nie są w stanie usunąć ich nadmiaru. W ten sposób ich funkcje zostają osłabione, w wyniku czego produkcja energii nie jest wystarczająca [15].
Poprzez zmniejszone wytwarzanie ATP, przy jednoczesnej ciągłej ekspozycji na wolne rodniki. Doprowadza to do braku równowagi pomiędzy antyoksydantami a reaktywnymi formami tlenu (stres oksydacyjny). Proces ten prowadzi do uszkodzeń bardzo ważnych cząsteczek m.in.: DNA, białek, lipidów. Komórka nie posiada wystarczającej ilości energii, by naprawić uszkodzone struktury. Dotyczyć to może każdego narządu. Jednak najbardziej narażone są te, z większym zapotrzebowaniem energetycznym [1,15]. Między innymi są to mózg, serce, mięśnie szkieletowe.
Na skutek tego procesu powstaje stres oksydacyjny, który prowadzi do przyspieszenia starzenia się organizmu. Mogą rozwinąć się również choroby neurodegeneracyjne, nowotwory oraz zespół metaboliczny [15]. Objawia się to, także poprzez nieustanne zmęczenie i problem z koncentracją.
Wśród osób, mających mitochondriopatie wtórne, częściej stwierdza się niską tolerancję alkoholu. Nierzadko występują również objawy niedocukrzenia [1]. Objawy mitochondriopatii wtórnej są niespecyficzne i ciężko je zdiagnozować. Z tego powodu zaburzenia te często pozostają nierozpoznane i przez to nie są poddawane terapii.
Objawy wtórnej mitochondriopatii:
- zaburzona glikemia,
- fibromialgia,
- zespół przewlekłego zmęczenia,
- migreny,
- alergie,
- bóle stawów,
- osłabienie układu immunologicznego,
- zaburzona praca jelit,
- problemy hormonalne,
- zespół wypalenia (burnout),
- depresja. [1,17,18]
Ostatnio coraz częściej wspomina się też o zaburzonej funkcji mitochondriów, w kontekście powstawania chorób cywilizacyjnych. Do tych schorzeń zalicza się choroby nowotworowe, miażdżycę, cukrzycę oraz otyłość [4]. Mitochondriopatie obejmują także choroby neurodegeneracyjne. Udowodniono, że w chorobie Parkinsona duży wpływ na rozwój choroby ma zaburzona praca tych organelli [5].
Przyczyny mitochondriopatii
Do głównych przyczyn zalicza się stres oksydacyjny w organizmie [1,15]. Mitochondria, oprócz produkcji energii odpowiadają również za inne procesy. Odpowiedzialne są za m.in.: równowagę pomiędzy wolnymi rodnikami a antyoksydantami. Nadzorują również apoptozę (zaprogramowaną śmierć komórki w organizmie). Zatem nieprawidłowe ich funkcjonowanie prowadzi do zaburzeń wielu ważnych mechanizmów. Dochodzi wtedy do uszkodzeń w materiale genetycznym. W wyniku czego rozwijają się choroby [1,15]
Do takich zaburzeń może dojść w wyniku:
- przewlekłego stresu,
- ekspozycji na metale ciężkie, środki ochrony roślin,
- nadmiernego opalania,
- obciążenia radioaktywnego,
- nadmiernego spożywania kalorii,
- niedoborowej diety,
- używek,
- leków (np. paracetamol, antybiotyki)[1,6].
Diagnostyka mitochondriopatii
Diagnostyka ma na celu wykryć defekt w pracy mitochondriów za pomocą badań laboratoryjnych. Najczęściej wykonuje się je z pobranej próbki krwi. Można wykonać także badanie moczu, aby zmierzyć stężenie kreatyniny.
Do zdiagnozowania mitochondriopatii wtórnej mogą posłużyć wskaźniki: Cyklu Krebsa, ATP, mleczanu, pirogronianu oraz stresu oksydacyjnego [1]. Stężenie mleczanu i pirogronianu pozwoli sprawdzić, czy metabolizm węglowodanów przebiega prawidłowo.
Parametry te pozwalają na określenie wydajności pozyskiwania energii z pożywienia. Ponadto można sprawdzić wysycenie organizmu niektórymi makro i mikroskładnikami oraz witaminami. Wyniki nie powinny być interpretowane samodzielnie przez pacjenta, ze względu na indywidualne różnice metaboliczne. Ich interpretacją powinien zająć się lekarz, znający tematykę mitochondriopatii [1].
Terapia mitochondrialna, czyli jak wspomóc mitochondria
Dieta przy mitochondriopatii
W terapii mitochondrialnej bardzo ważny jest styl życia. Największe znaczenie ma tutaj odżywianie oraz aktywność fizyczna. Z uwagi na wyższe ryzyko stresu oksydacyjnego, dieta powinna obfitować w związki antyoksydacyjne [1,15]. Znaleźć je można głównie w warzywach oraz owocach.
W przypadku mitochondriopatii wtórnych rekomendowana przez doktora Boda Kuklińskiego jest dieta LOGI (Low Glicemic Index). W tym modelu ogranicza się węglowodany na rzecz tłuszczów. Dostarczane są w ilości około 50% całodziennej energii. Węglowodany stanowią 30%, a białko 20%.
W pewnym badaniu, w klinice rehabilitacyjnej w Überruh, przeprowadzonym na 45 otyłych pacjentach, chorujących na cukrzycę, wprowadzono żywienie typu LOGI. Po 3 tygodniach zauważono wyraźny spadek masy ciała oraz poprawę wrażliwości na insulinę. Dieta pozytywnie wpłynęła również na obniżenie trójglicerydów oraz stosunek cholesterolu LDL do HDL [9,10].
W mitochondriopatii metabolizm węglowodanów często jest zaburzony. Zatem w przypadku stosowania wysokowęglowodanowej diety, nadmiar glukozy zostanie odłożony w tkankę tłuszczową [9,10]. Ważny jest rodzaj tłuszczów dostarczanych wraz z pożywieniem. Zmniejszenie spożycia tłuszczów nasyconych (smalec, boczek), na rzecz wielonienasyconych, daje pozytywne efekty. Znajdują się one w oliwie z oliwek, oleju lnianym, awokado czy oleju z wiesiołka.
Z diety powinno się całkowicie wyeliminować prozapalne tłuszcze trans. Znajdują się one w żywności typu fast food, w słodyczach i gotowych wyrobach cukierniczych. Gdy przyczyną mitochondriopatii jest nadmiar tlenku azotu, może być to spowodowane niedoborem witaminy B12 [1,10]. Według doktora Boda Kuklińskiego, diety wegetariańskie/wegańskie, mogą być wtedy niewskazane [1,10]. Gdyż osoby będące na dietach roślinnych są szczególnie narażone na jej niedobór [1,10]. Niedostateczna podaż tej witaminy zwiększa ryzyko uszkodzenia DNA mitochondriów przez tlenek azotu [10]. W takim przypadku konieczna jest suplementacja, a dawkę powinien ustalać lekarz.
Aktywność fizyczna
Codzienny dłuższy spacer, joga, umiarkowane ćwiczenia z obciążeniem, energiczny marsz. Te ćwiczenia mogą wspomagać pracę mitochondriów. Istotne jest, aby rodzaj aktywności fizycznej nie był nadmiernie obciążający organizm. Najlepiej, aby odbywał się na świeżym powietrzu. Taki ruch dodatkowo wpływa na redukcję stresu, obniżenie stanów zapalnych i poprawię wydolności organizmu.
W przypadku wysokiej aktywności fizycznej wzrasta poziom wolnych rodników. Dlatego taka aktywność w przypadku mitochondriopatii nie jest korzystna. A może prowadzić do pogorszenia stanu zdrowia [1].
Witaminy i mikroelementy
Mitochondria w szczególności potrzebują witamin z grupy B [1,6,19]. Służą jako kofaktory dla enzymów odpowiadających m.in. za wytwarzanie energii [19]. Uczestniczą w metabolizmie tłuszczów i węglowodanów oraz tworzeniu karnityny. Karnityna to związek chemiczny powstały z aminokwasów lizyny i metioniny. Bierze ona udział transporcie kwasów tłuszczowych do mitochondriów, gdzie ulegają utlenieniu. Dzięki temu powstaje energia.
Niedobór tego związku często stwierdza się w mitochondriopatii [11]. Mitochondria do prawidłowego funkcjonowania potrzebują żelaza [1,12]. Pierwiastek ten uczestniczy w procesie oddychania komórkowego oraz tworzeniu DNA. Służy jako składnik pewnych enzymów, biorących udział w tworzeniu energii w organizmie [12]. Cynk i selen wpływają na poprawę odporności i funkcji antyoksydacyjnych [1].
Jak wcześniej wspomniano, mitochondria są bardzo narażone na działanie wolnych rodników. Dlatego poprawa procesów antyoksydacyjnych jest bardzo istotna Cynk poprzez uczestnictwo w metabolizmie kwasów tłuszczowych i węglowodanów. Bierze udział, także w procesie wytwarzania energii w mitochondriach [13].
Produkcja energii jest zależna również od magnezu. Pierwiastek ten bierze udział w syntezie wielu enzymów w mitochondriach. ATP (cząsteczka energii) łączy się z jonem magnezu, tworząc biologicznie aktywny kompleks. Zatem magnez jest niezbędny do wykorzystania ATP. Ponadto magnez magazynowany jest właśnie w mitochondriach [14].
Inne składniki odżywcze
Koenzym Q10 to składnik niezbędny w procesie wytwarzania energii w mitochondriach [1]. Uczestniczy w procesie oddychania komórkowego, dzięki czemu wytwarzana jest energia. Bierze udział również w unieszkodliwianiu wolnych rodników.
Koenzym może być tworzony samodzielnie w organizmie, jeśli są spełnione pewne warunki. Powstaje on wówczas, jeśli stężenie składników mineralnych oraz witamin z grupy B są na odpowiednim poziomie. W sytuacji, gdy występują niedobory tychże składników, synteza koenzymu Q10 jest zablokowana [1]. Na obniżenie jego stężenia mają wpływ także: stres, sporty ekstremalne, choroby serca, mózgu oraz zabiegi operacyjne [1].
Glutation oraz kwas alfa-liponowy to związki o silnym potencjale antyoksydacyjnym [6]. W związku z tym rekomenduje się ich zastosowanie w terapii w postaci suplementów [1]. Produkcję glutationu w organizmie można zwiększyć poprzez stosowanie NAC ( N-acetylocysteiny). Związek ten jest pochodną cysteiny, która należy do aminokwasów endogennych. W wielu badaniach stosowanie NAC w postaci suplementu wyraźnie poprawiło procesy antyoksydacyjne w organizmie [20, 21].
Warto wdrożyć suplementację kwasami omega 3, które neutralizują wolne rodniki oraz poprawiają funkcjonowanie mitochondriów [8]. Warto zaznaczyć, że przy niedoborze karnityny transport kwasów omega 3 może być upośledzony [1]. Karnityna służy jako transporter kwasów tłuszczowych do mitochondriów, gdzie służą do produkcji energii [1].
Podsumowanie
O chorobach mitochondriów w ostatnim czasie mówi się coraz więcej. Dotychczas głównie omawiano mitochondriopatie pierwotne o podłożu genetycznym. Jednak w ostatnich latach częściej wspomina się także o wtórnych, powstałych na skutek czynników środowiskowych. Mitochonriopatie obejmują wiele powszechnie występujących schorzeń. Między innymi: cukrzycę, choroby jelit, otyłość, przewlekłe zmęczenie itp.
Wiele badań udowodniło silny związek pomiędzy mitochondriami a rozwojem tych chorób. Zatem wspomaganie ich pracy może okazać się niezbędne, w celu redukcji negatywnych objawów, lub całkowitego wyleczenia. Wspomóc można je poprzez zdrową dietę, umiarkowaną aktywność fizyczną oraz dobór odpowiedniej suplementacji.
Bibliografia:
- Kuklinski B., Schemionek A. (2018). Medycyna Mitochondrialna. Wyd. Vital.
- Buglioni A. in. (2021).Mitochondriopathy Manifesting as Inherited Tubulointerstitial Nephropathy Without Symptomatinc Other Organ Involvement. Kidney Int. Rep. 6(9)
- Polskie Towarzystwo Biochemiczne. (2008).Postępy Biochemii. Tom 54, Nr. 2.
- Shemiakova T. i in. (2021). Atherosclerosis as Mitochondriopathy: Repositioning the Disease to Help Finding New Therapies. Front. Cardiovasc. Med.
- Prasuhn J., Davis R. L., Kumar K.R.(2020). Targeting Mitochondrial Impairment in Parkinson’s Disease: Challenges and Opportunities. Front Cell Dev Biol.
- Kuklinski B., Lunteren I. (2017). Odżywianie Mitochondrialne. Wyd. Vital.
- Rattay T.W, Kluba T., Schöls L.(2021). Chromium and cobalt intoxication mimicking mitochondriopathy. Neurol. Res. Pract 3:40.
- Putti R., Sica R., Migliaccio V., Lionetti L.(2015). Diet impact on mitochondrial bioenergetics and dynamics Pobrano 24 maja 2022, z https://www.frontiersin.org/articles/10.3389/fphys.2015.00109/full
- Heilmeyer, P., Kohlenberg, S., Dorn, A..: Ernährungstherapie bei Diabetes mellitus Typ Ii mit kohlenhydratreduzierter Kost (Logi-Methode). Internist. Praxis 46 (2006) 181 – 191.
- Kuklinski B. Nahrungsfett, metabolisches Syndrom, mitochondriale Zytopathie. Pobrano 24 maja 2022, z https://www.dr-kuklinski.info/wp-content/uploads/2019/08/kuklinski-nahrungsfett-metabolisches-syndrom-mitochondriale-zytopathie.pdf
- Parikh S.(2009).A Modern Approach to the Treatment of Mitochondrial Disease. Curr. Treat Options Neurol. 11(6): 414–430.
- 15. Paul B.T, Manz D.H.,Torti F.M., Tort S.V. (2017). Mitochondria and Iron: Current Questions. Expert Rev Hematol. 10(1): 65–79.
- Yang X. i in. (2017). Zinc enhances the cellular energy supply to improve cell motility and restore impaired energetic metabolism in a toxic environment induced by OTA. Scientific Reports.
- Yamanaka R., i in. (2016). Mitochondrial Mg2+ homeostasis decides cellular energy metabolism and vulnerability to stress. Scientific Reports.6: 30027.
- Liskova A., i in. (2021). Mitochondriopathies as a Clue to Systemic Disorders-Analytical Tools and Mitigating Measures in Context of Predictive, Preventive, and Personalized (3P). Medicine. Int. J. Mol. Sci. 22 (4).
- Boguszewska K.,Szewczuk M.,Kaźmierczak-Barańska J., Karwowski B. (2020).The Similarities between Human Mitochondria and Bacteria in the Context of Structure, Genome, and Base Excision Repair System. Molecules 2020, 25(12).
- Reduzierte Aktivität der Mitochondrien als Ursache depressiver Symptome? Pobrano 10.08.2022 z https://www.thieme.de/de/psychiatrie-psychotherapie-psychosomatik/reduzierte-aktivitaet-mitochondrien-ursache-depressiver-symptome-64571.htm
- Bansal Y.,Kuhad A.(2016) Mitochondrial Dysfunction in Depression. Curr Neuropharmacol 14(6): 610–618.
- Kucharská J.(2013). Vitamins in Mitochondrial Function. Mitochondrial Medicine.367–384.
- Kasperczyk S., Dobrakowski M., Kasperczyk A., Ostałowska A., Birkner E.(2013). The administration of N-acetylcysteine reduces oxidative stress and regulates glutathione metabolism in the blood cells of workers exposed to lead. Clin Toxicol (Phila). 51(6):480-6.
- Choy K.H.CH., Dean O., Berk M., Bush A.I., Buuse M. (2010). Effects of N-acetyl-cysteine treatment on glutathione depletion and a short-term spatial memory deficit in 2-cyclohexene-1-one-treated rats. European Journal of Pharmacology. Volume 649, Issues 1–3: 224-228.