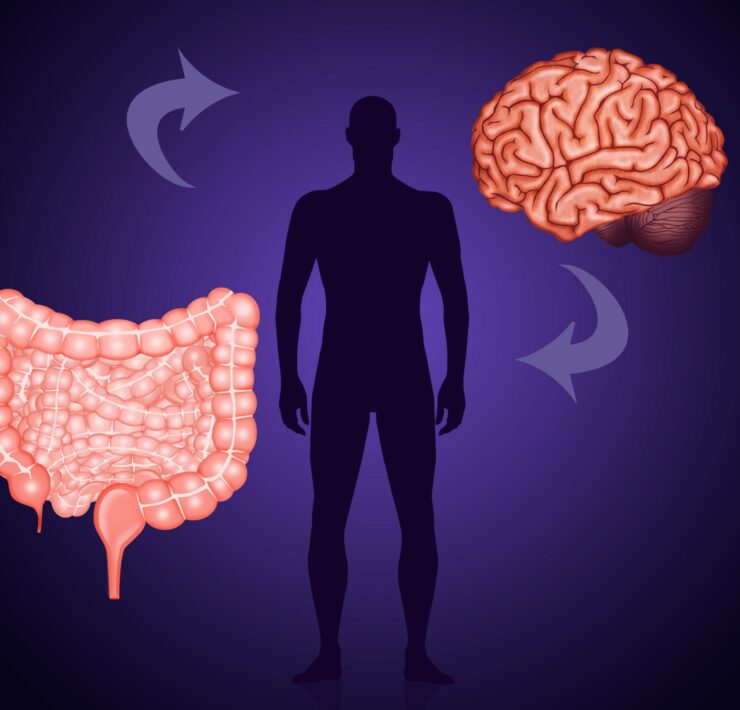
Jelita są często określane jako nasz drugi mózg. Określenie to nie powinno dziwić po zapoznaniu się z informacją na temat ilości neuronów znajdujących się w jelitach. Dr Michael Gershon z Columbia University Medical Center oszacował zawartość neuronów w jelicie na poziomie około 200 milionów. Jelitowy układ nerwowy określany jest jako enteryczna część układu nerwowego (ENS) i jest regulowany przez ośrodkowy układ nerwowy (OUN) w wyniku bodźców, jakie docierają do nas z otoczenia np. zapach, smak, obraz czy dźwięk [1].
Jelita i układ nerwowy
Rdzeń kręgowy autonomicznego układu nerwowego przekazuje impulsy nerwowe dostarczane przez OUN do części enterycznej układu nerwowego. Jako nieodłączny element ENS przedstawia się skład flory bakteryjnej jelit określany jako mikrobiota. W obu częściach osi mózgowo-jelitowej, czyli połączenia między mózgiem, jelitami a mikrobiotą wytwarzane są neurotransmitery jak acetylocholina czy serotonina oraz neuropeptydy takie jak peptyd YY, polipeptyd trzustkowy PP, glukagonopodobny peptyd 1 czy cholecystokinina.
Mózg jest połączony z jelitami za pomocą nerwu błędnego, poprzez który następuje wymiana nośników „informacji” za pomocą wyżej wymienionych przekaźników. Prawidłowy przebieg wymiany informacji inaczej mówiąc wzajemnej komunikacji między OUN a ENS, jest uznawany za podstawę utrzymania zdrowia człowieka. W niektórych badaniach przedstawiono tezę na temat wzajemnego modulowania ośrodków osi jelitowo-mózgowej [2].
Wpływ mózgu na funkcje jelit jest znany wszystkim nie od dzisiaj. Zaburzenia funkcjonowania jelit są najbardziej widoczne w wyniku oddziaływania stresu. Objawami oddziaływania na nasz organizm czynników stresogennych są często: skurcze, biegunki oraz silne bóle w obrębie dolnej części brzucha. Według obecnych badań możliwy jest również wpływ mikrobioty na OUN. Wpływ ten jest związany z wytwarzaniem przez ENS neurotransmiterów oraz neuromodulatorów takich jak serotonina czy acetylocholina. Na uwagę zasługuję również połączenie ENS z autonomicznym układem nerwowym (AUN) poprzez współczulne i przywspółczulne odgałęzienia AUN oraz już wcześniej wymieniony nerw błędny będący przywspółczulnym odgałęzieniem AUN. Mikrobiota, może wpływać na organizm człowieka, poprzez neuroprzekaźniki, hormony oraz aktywację układu immonologicznego.
Przykładem mogą być tutaj cytokiny prozapalne wytwarzane przez ENS, które wpływają na konkretny obszar mózgu, przez co oddziałują na funkcjonowanie OUN. Działanie nerwu błędnego może wpływać na regulację osi podwzgórze-przysadka-nadnercza (HPA), a co za tym idzie oddziaływać na zmniejszenie występowania objawów depresji. Zmiany w działaniu osi podwzgórze-przysadka-nadnercza wywoływane przez kortyzol w wyniku stresu, mogą również wpływać na skład i funkcjonowanie mikrobioty.
Wytwarzane przez mikrobiotę substancje neuroaktywne uczestniczą w komunikacji między jelitami a mózgiem oraz mogą przyczyniać się do zmiany w jego funkcjonowaniu [2].
Na skład mikrobioty wpływają zarówno czynniki wewnętrzne, jak i zewnętrzne. Do czynników zewnętrznych zalicza się m.in. wiek, sposób urodzenia, spożycie antybiotyków, sposób żywienia. Zgoła innym tematem jest zależność składu mikrobioty od działania mięśni szkieletowych.
Hipoteza osi jelitowo-mięśniowej
Temat mikrobioty i zależności, jakie je łączą z resztą organizmu, jest nieustannie poszerzany. Dlatego też doszło do stworzenia hipotezy, mówiącej o wzajemnej zależności pomiędzy działaniem mikrobioty a działaniem mięśni szkieletowych. Badania na temat hipotezy osi jelitowo-mięśniowej rozpoczęły się od osób starszych, wśród których zaobserwowano występowanie sarkopenii. Jednak coraz większa ilość opracowań dotyczy osób aktywnych i sportowców. W poniższym artykule zostaną przedstawione argumenty świadczące za oraz przeciwko istnieniu tego ciekawego zjawiska. Ponadto omówione zostaną zaobserwowane dotychczas zależności łączące te dwa elementy ludzkiego organizmu.
Ilość masy mięśniowej
Pierwsze doniesienia na temat związku pomiędzy mikrobiotą a ilością masy mięśniowej związane były ze zmianami w obszarze flory bakteryjnej osób starszych, chorujących na sarkopenię. Zaburzenia w obszarze mikrobioty związane są ze zwiększoną cyrkulacją LPS również w obszarze masy mięśniowej. Toksyczne działanie LPS ma przyczyniać się do zmniejszonej syntezy białek mięśniowych oraz nasilonego stanu zapalnego w obrębie tkanki mięśniowej związanego ze zwiększeniem się wydzielania IL-6 oraz TNF-alfa.
Zwiększający się wraz z wiekiem poziom endotoksyn, związany jest ze zmniejszeniem się poziomu masy mięśniowej wśród osób starszych. Wpływanie na ilość masy mięśniowej poprzez modyfikację mikroflory jest kwestią niezwykle interesującą. Jednak dotychczasowe badania opierają się głównie na modelu zwierzęcym.
W jednym z pierwszych badań na ten temat sprawdzano wpływ spożycia probiotyków przez myszy w stanie skrajnego wyniszczenia organizmu, z zanikiem zarówno tkanki tłuszczowej, jak i mięśniowej. W przypadku zastosowania bakterii z gatunku Lactobacillus acidophilus nie zanotowano zmian w poziomie stanu zapalnego oraz ilości masy mięśniowej. Natomiast spożycie bakterii z gatunku L. plantarum wpłynęło na zwiększenie się masy i siły mięśniowej.
Kilka kolejnych badań potwierdziło tę zależność. Badania dotyczące spożycia probiotyków, wykazują, że najkorzystniejszy efekt obserwuję się w przypadku zwiększenia poziomu bakterii Lactobacillus oraz Bifidobacterium spp. Zmniejszający się wraz z wiekiem poziom Bifidobacterium wiązany jest z ilością krążącego LPS, komunikacją jelita z mięśniami oraz ilością masy mięśniowej.
Nie ma jednak badań wykazujących, że suplementacja Bifidobacterium wpływa na zwiększenie się masy mięśniowej. Powyższe wnioski oparte są na zależności pomiędzy produkcją maślanu przez wyżej wymienione bakterie. Obecne doniesienia świadczą o protekcyjnym działaniu maślanu względem zmniejszania się masy mięśniowej wraz z wiekiem. Dlatego też zaburzenia w ilości Bifidobacterium oraz maślanu wiązane są ze zmniejszeniem masy mięśniowej wśród osób w starszym wieku [4].
W kilku badaniach, na temat związku pomiędzy wzrostem beztłuszczowej masy ciała a składem mikrobioty, odnotowano wzrost poziomu beztłuszczowej masy ciała (LBM) po zastosowaniu antybiotyków wśród myszy, pozbawionych flory bakteryjnej. Warto jednak wspomnieć, że beztłuszczowa masa ciała nie odnosi się tylko to masy mięśniowej oraz podkreślić fakt, że po zastosowaniu niektórych antybiotyków może dojść do przerostu jelita ślepego. Natomiast w omawianych badaniach nie wymieniono jaki wzrost masy mięśniowej nastąpił po przeprowadzonej interwencji [5].
Ciekawą kwestią jest również fakt, że po zastosowaniu diety bogatej w błonnik oraz wprowadzeniu wysiłku fizycznego w jelitach dochodzi do zwiększonej produkcji octanu, propionianu oraz maślanu. Niektóre badania potwierdzają również wzrost siły mięśniowej, wśród osób starszych po wprowadzeniu diety bogatej w błonnik. Wśród młodych osób uczestniczących w 6 tygodniowym programie ćwiczeń aerobowych zaobserwowano wzrost stężenia SCFA. W przypadku osób starszych, wśród których przeprowadzono 12-tygodniową interwencję, polegającą na wykonywaniu treningu wytrzymałościowego, zanotowano wzrost liczby Bacteriodetes [5].
W badaniu z 2017 roku sprawdzano jak spożycie kazeiny lub białka sojowego, wpłynie na skład flory bakteryjnej wśród otyłych osób. Podczas 3 tygodni interwencji uczestnicy spożywali suplementy o tej samej ilości kalorii. W rezultacie nastąpiło zwiększenie aktywności bakterii odpowiedzialnych za degradacje i fermentację aminokwasów. Wyniki powyższego badania, mogą wskazywać na to, że mikroflora jelitowa może przyczyniać się do nasilenia anabolizmu białek poprzez zwiększenie biodostępności aminokwasów, stymulowanie wydzielania insuliny oraz zwiększenie wrażliwości mięśni szkieletowych.
Badania przeprowadzone na modelu zwierzęcym wykazały, że mikrobiota produkuje większe ilości aminokwasów rozgałęzionych z jednoczesnym zwiększeniem wrażliwości na insulinę, oraz zwiększoną syntezą białek mięśniowych. Powyższe obserwacje nie zostały jednak potwierdzone przez badania na ludziach. W których to dochodzi do zjawiska odwrotnego, a mianowicie zwiększonej obecności BCAA w surowicy oraz zmniejszonej wrażliwości na insulinę. Dieta o wysokiej zawartości białka, może wpływać na zmniejszenie się stosunku Firmicutes do Bacteriodetes przy jednoczesnym wzroście ilości patogenów oraz zmniejszeniu się ilości bakterii produkujących SCFA. Powyższe zmiany w obrębie mikrobioty, mogą wpływać na metabolizm w obrębie tkanki mięśniowej, wrażliwość na insulinę oraz generowanie stanu zapalnego. Wyniki badań na ludziach dają podobne rezultaty [7].
Zmiany w składzie masy mięśniowej
Wraz z wiekiem obserwuje się nie tylko zmniejszenie masy mięśniowej, a co za tym idzie i siły mięśniowej, ale równie zmiany w obrębie składu tkanki mięśniowej. W dotychczasowych badaniach zaobserwowano zmiany w kompozycji tkanki mięśniowej, polegające na zwiększeniu się ilości adipocytów wewnątrz tkanki mięśniowej. Wnioski płynące z badań na myszach świadczą o związku pomiędzy składem mikrobioty a kompozycją masy mięśniowej, ze względu na zawartość bakterii, związanych produkcją energii. Jednak podobnie, jak w przypadku doniesień o związku ilości masy mięśniowej ze składem mikrobioty, badania opierają się na modelu zwierzęcym [6].
W przypadku zmiany kompozycji masy mięśniowej wraz z wiekiem ciekawym zagadnieniem jest zmiana szybkokurczliwych włókien mięśniowych na wolnokurczliwe. W jednym z badań przeszczepiono mikrobiotę jelitową z otyłych świń, do pozbawionych flory bakteryjnej myszy. W wyniku zastosowanej interwencji doszło do odzwierciedlenia procesu zaniku mięśni w wyniku starzenia się. W teorii może to świadczyć o możliwości modulacji masy mięśniowej poprzez zmianę składu mikroflory jelitowej [6]. Jednak są to tylko teoretyczne rozważania.
Czynniki wpływające na stan mikrobioty
Mikrobiota jest niezwykle różnorodnym, dynamicznie zmieniającym się oraz indywidualnym ekosystemem znajdującym się w ludzkim organizmie. Na jej kształt wpływa niezmiernie wiele czynników, zaczynając od metody porodu, przez sposób karmienia, dorastanie w konkretnym otoczeniu, dorastaniem w otoczeniu zwierząt, historię stosowania antybiotyków oraz ekspozycję na zanieczyszczenie środowiska.
Do czynników o potencjalnym, jednak mniej udokumentowanym działaniu na mikrobiotę, zalicza się m.in. model żywienia ukierunkowany na określoną dyscyplinę sportową oraz interakcje ze środowiskiem. Trening ukierunkowany na wynik sportowy wiąże się z występowaniem metabolicznych oraz fizjologicznych adaptacji u sportowca. Adaptacje te wpływają również na zmiany w obrębie mikrobioty, która pośrednio oddziałuje na wydolność sportową, regenerację, podatność na infekcje.
Jest to związane z przekazywaniem sygnałów poprzez miokiny oraz inne cytokiny, wpływem na aktywność osi podwzgórze-przysadka- nadnercza, przez co może wpływać na szlaki metaboliczne, związane z wydolnością fizyczną [3]. Pomimo rozwoju technik, związanych z analizą mikrobioty, różnorodność otrzymywanych wyników badań utrudnia postawienie konkretnych wniosków.
Dotychczasowe wnioski dotyczące badań nad mikrobiotą nie zawsze brały pod uwagę takie czynniki wpływające na jej skład jak sposób żywienia, płeć, pochodzenie, problemy z układem pokarmowym, oraz spożywanie antybiotyków [3].
Dokonanie analizy składu mikrobioty osób aktywnych oraz sportowców jest o tyle trudne, że pomijając różnorodność dotychczas wykorzystywanych metod analitycznych, występuje również olbrzymia różnorodność, dotycząca przebiegu makrocyklu treningowego każdego sportowca. Ponadto czynniki wymienione wcześniej, również mogą wpływać na kształtowanie się mikrobioty. Jak można zauważyć, na końcowy efekt w postaci zawartości poszczególnych szczepów bakterii w jelicie ma wpływ olbrzymia ilość czynników [3].

Zależność pomiędzy poziomem wytrenowania a składem mikrobioty
Porównując skład mikrobioty wytrenowanych kolarzy oraz osób amatorsko trenujących kolarstwo, nie zaobserwowano związku pomiędzy poziomem wytrenowania a składem mikrobioty. Jednak zaobserwowano związek pomiędzy ilością godzin treningowych w ciągu tygodnia a zwiększoną ilością bakterii rodzaju Prevotella związanej z metabolizmem aminokwasów rozgałęzionych (BCAA).
Zaobserwowano również zwiększoną transkrypcję bakterii Methanobrevibacter smithii wśród zawodowych kolarzy. Bakterie te mają wpływ na zwiększoną ekspresję genów związanych z produkcją metanu. Zwiększona produkcja metanu może przyczynić się do zwiększenia szybkości energetycznych szlaków metabolicznych oraz metabolizmu węglowodanów. W badaniu Clerke i wsp. odnotowano natomiast niską obfitość w przypadku bakterii Bacteroides wśród zawodowych sportowców. Natomiast bakterie Akkermansia były obecne wśród 30 z 33 sportowców, w tym wśród 7 z nich ilość była obfita. Bakterie te są powiązane ze zdrowym profilem metabolicznym [3].
Zależność pomiędzy uprawianą dyscypliną sportu a składem mikrobioty
O’Donovan i wsp. dokonali porównania flory bakteryjnej 37 sportowców różnych dyscyplin sportowych, wśród których wielu brało udział letniej olimpiadzie w 2016 roku. W badaniu porównywano ilość dynamicznych oraz statycznych składowych wykonywanych ćwiczeń w każdym ze sportów.
W wyniku tego dokonano podziału ze względu na charakter wysiłku fizycznego. Wśród atletów, którzy wykonywali wysiłek o dynamicznym charakterze, występowała największa różnorodność w proporcji poszczególnych gatunków. Sportowcy wykonujący wysiłki zawierające zarówno dynamiczne, jak i statyczne elementy, wykazywali największą różnorodność w potencjale funkcjonalnym. Badacze odnotowali również różnice w przypadku metabolitów zawartych w kale oraz moczu sportowców. Zaobserwowano zwiększoną ilość mleczanu w moczu osób, których dyscypliny charakteryzowały się elementami statycznymi. Natomiast w przypadku osób trenujących dyscypliny o charakterze wysiłków dynamicznych z elementami statycznymi odnotowano większą zawartość kreatyniny w kale.
W jednym z badań sprawdzano wpływ określonego modelu żywienia związanego z uprawianą dyscyplina sportu na skład flory bakteryjnej zawartej w kale kulturystów, biegaczy długodystansowych oraz jako grupa kontrolna badane były osoby o siedzącym trybie życia.
Wśród kulturystów odnotowano zwiększoną ilość bakterii z rodzaju Faecalibacterium, Saturella, Clostridium, Haemophilus, oraz Eisenbergiella, natomiast zmniejszoną ilość bakterii z rodzaju Bifiobacterium oraz Parasutterella. Ilość bakterii z gatunków Bifidobacterium adolescentis, Bifidobacterium longum, Lactobacillus sakei oraz Blautia wexlerae i Eubacterium halli, również była najniższa wśród kulturystów, natomiast najwyższa w grupie kontrolnej [3].
Rodzaj aktywności a skład mikrobioty
Istnieje mała liczba badań, dotyczących związku pomiędzy rodzajem aktywności fizycznej a składem mikrobioty. Natomiast te istniejące świadczą wyższej zawartość oraz różnorodność prozdrowotnych gatunków bakterii wśród sportowców. Skład ciała oraz aktywność fizyczna jest związana z kilkoma rodzajami bakterii. Odrębność w składzie flory bakteryjnej sportowców może mieć wpływ na naprawę tkanek, zwiększoną zdolność do metabolizowania węglowodanów, budowę komórek oraz syntezę nukleotydów [3].
Wpływ wysiłku fizycznego na skład mikrobioty jelitowej
Mechanizm związany z wpływem wysiłku fizycznego na mikrobiotę jest nie do końca poznany. Jednak za ten wpływ odpowiadają zarówno czynniki wewnętrzne, jak i zewnętrzne. Osoby aktywne fizyczne często, choć nie zawsze, więcej czasu spędzają na zewnątrz. Co za tym idzie mają większy kontakt ze środowiskiem zewnętrznym oraz często prowadzą zdrowy tryb życia. Ponadto adaptacja do wysiłku wiąże się ze zmianami metabolicznymi oraz fizjologicznymi. W przypadku adaptacji do wysiłku wytrzymałościowego dochodzi do obniżenia ciśnienia krwi, niedotlenienia tkanek, zwiększonego transportu oraz wchłaniania składników odżywczych.
Powtarzane pojedyncze wysiłki o charakterze aerobowym mogą wpływać na przedłużenie się pasażu jelitowego wśród osób zdrowych i osób w średnim wieku z nawracającymi zaparciami [3]. W przypadku intensywnych wysiłków dochodzi do opóźnienia opróżniania żołądka. Zmiany adaptacyjne wywołane wysiłkiem fizycznym, jak zmiany pH w obrębie jelita, może przyczyniać się do korzystniejszych warunków dla zwiększonej różnorodności oraz funkcji metabolicznych flory bakteryjnej w jelitach.
Intensywne wysiłki o długim czasie trwania mają szkodliwy wpływ na funkcjonowanie jelit. Wysiłek fizyczny prowadzi do przekierowania krwi z jelit to pracujących mięśni. Przedłużona hiperperfuzja prowadzi do uszkodzenia enterocytów. Efekt ten jest częsty w przypadku sportów o charakterze wytrzymałościowym. Może to prowadzić do przemieszczania się endotoksyn do krążenia ogólnoustrojowego.
Aktywność fizyczna może korzystnie wpływać na objawy żołądkowo-jelitowe wśród osób z zespołem jelita drażliwego. W tej chwili dowody naukowe, którymi dysonujemy, świadczą o korzyściach, wynikających z aktywności fizycznej, w przypadku jakościowych oraz ilościowych zmian w obrębie składu i funkcji bakterii jelitowych [3].
Związek pomiędzy mikrobiotą a metabolizmem mięśni szkieletowych
Mikrobiota ze względu na swoje położenie pełni istotną funkcję w metabolizmie składników odżywczych oraz syntezie aminokwasów. W przypadku takich jednostek chorobowych jak Kwashiorkior czy otyłość dochodzi do zmian w obrębie mikrobioty. Dietetyczne środki lecznicze umożliwiające zmiany w obrębie konkretnych bakterii prowadzą do zmniejszenia nasilenia powyższych jednostek chorobowych.
Wyniki badań świadczą o możliwości regulowania metabolizmu przez mikrobiotę. Niektóre wyniki świadczą również o tym, że mikrobiota może wpływać na aktywność mięśni szkieletowych [4].
W badaniu z 2004 roku zaobserwowano o 60% większy poziom tkanki tłuszczowej wśród myszy pozbawionych flory bakteryjnej w porównaniu do grupy kontrolnej. Jednocześnie wystąpiło zmniejszenie wrażliwości insulinowej oraz tolerancji glukozy. Powyższe doniesienia doprowadziły do wniosku o występowaniu zależności pomiędzy mikrobiotą a funkcjami metabolicznymi mięśni szkieletowych. W celu dokładniejszego poznania powyższych zależności ponownie na modelu zwierzęcym porównywano aktywność białek mięśni szkieletowych myszy pozbawionych flory bakteryjnej oraz grupy kontrolnej. W przypadku myszy pozbawionych flory bakteryjnej odnotowano zwiększoną aktywność enzymów, świadczących o zwiększonej zdolności oksydacyjnej tkanki mięśniowej [4].
Powyższe doniesienia mogą świadczyć o zależności pomiędzy mikrobiotą oraz kompozycją składu ciała. Oczywiście badania te nie uwzględniają szeregu czynników, o których mowa była wcześniej oraz przede wszystkim przeprowadzone są na modelu zwierzęcym.
Związek pomiędzy składem diety sportowca a składem mikrobioty
Dieta sportowca jest charakterystyczna dla uprawianej dyscypliny sportu. Jednak w większości przypadków charakteryzuje się zwiększonym spożyciem energii. W przypadku niewystarczającego spożycia energii może dojść do pogorszenia wyników sportowych, zmian w działaniu układu hormonalnego, immunologicznego, obniżenia zasobów glikogenu, oraz zmian w obrębie mikrobiomu.
Niedobór węglowodanów jako głównego źródła energii może przyczyniać się do zahamowania biogenezy i funkcji mitochondriów oraz wpływać na zmniejszoną tolerancję treningu. Bakterie jelitowe uczestniczą w regulowaniu fermentacji węglowodanów oraz wytwarzania z nich SCFA. Diety o niskiej ilości węglowodanów wiązane są ze zmniejszona wydolnością treningową.
W przypadku zastosowania diety niskiej zawartości węglowodanów oraz o wysokiej podaży tłuszczy obserwuje się obniżenie ilości substratów niezbędnych do produkcji SCFA. W przypadku diety wysokotłuszczowej obserwuje się również zwiększoną produkcję cytokin prozapalnych, zwiększoną ilość LPS (lipopolisacharydu), oraz NF-kb związanego z ekspresją genów o działaniu prozapalnym.
Wykazano również zwiększoną ilość bakterii redukujących siarczany. Siarczki prowadzą do rozpadu żelu złożonego z białek MUC2. Zmiany w obrębie białek MUC2, mogą prowadzić do zaburzeń w regeneracji oraz stabilności błony śluzowej. Warto jednak zauważyć, że odnotowane zmiany zostały zaobserwowane w przypadku diety wysokotłuszczowej, zawierającej w dużych ilościach nasycone kwasy tłuszczowe i żywność przetworzoną. W przypadku diety o wysokiej zawartości omega 3 oraz CLA nie odnotowano powyższych zaburzeń [8].
Podaż białka na poziomie rekomendowanym dla sportowców jest kwestią niezwykle istotną. Głównie ze względu na potrzeby związane z hipertrofią mięśniową oraz budowaniem siły mięśniowej. W przypadku nadmiernego spożycia białka obserwuję się jednak zmiany w obrębie mikrobioty. Zmiany te obejmują zwiększenie się liczby bakterii odpowiedzialnych za fermentacje białka (m.in. Clostridium, Desulfovibrio, Peptostreptococcus, Acidaminococcus, Veillonella, Propionibacterium, Bacillus, Bacteroides, Staphylococcus) oraz zmniejszenie się ilości bakterii odpowiedzialnych za fermentację węglowodanów (m. in Bacteroides, Lactobacillus, Bifidobacterium, Prevotella, Ruminococcus, Roseburia, Faecalibacterium).
Niestrawione produkty fermentacji białka, zalegające w okrężnicy, mogą się przyczyniać do nadmiernego wytwarzania amoniaku, amin biogennych, związków indolowych i fenoli. Związki te mogą prowadzić do niekorzystnych zmian w obrębie jelita, ale również wpływać na układ immunologiczny i neurologiczny. Zwiększenie ilości węglowodanów oraz wprowadzenie umiarkowanego wysiłku fizycznego prawdopodobnie może niwelować ten efekt.
Obserwacje dotyczące składu mikrobiomu sportowców pokazują, że w tej grupie osób występuje wyższa ekspresja genów bakteryjnych związanych z metabolizmem białek węglowodanów, oraz SCFA. We wcześniej wspomnianym badaniu [3] zwiększenie liczby bakterii Prevotella skutkowało zwiększoną biosyntezą lizyny, alaniny, asparaginianu i glutaminianu, d-glutaminy i d-glutaminianu, a także zwiększonym metabolizmem węglowodanów.
Badanie przeprowadzone przez Durka i wsp. wykazało dodatni związek między poziomem wytrenowania wyrażonym maksymalnym poborem tlenu (VO2max) a stosunkiem Firmicutes do Bacteroidetes. Obecne doniesienia wskazują również, że optymalny skład mikrobioty jelitowej może pozytywnie wpływać na pracę mózgu i zapobiegać depresji poprzez modulowanie stanu zapalnego i wpływ na metabolizm tryptofanu [8].
Jak już wcześniej wspomniano, nadmierny wysiłek fizyczny może wpływać na niekorzystne zmiany w obrębie jelit. Niedokrwienie, zwiększona przepuszczalność bariery jelitowej oraz podwyższony poziom stresu oksydacyjnego, mogą prowadzić do zaostrzenia odpowiedzi zapalnej, zwiększonego katabolizmu oraz pogorszenia funkcjonowania tkanki mięśniowej.
Niekorzystne skutki, mogą również wynikać ze wzrostu liczby potencjalnie szkodliwych bakterie, jakPeptostreptococcus, Staphylococcus, Peptoniphilus, Acidaminococcus, i Fusobacterium oraz do spadku liczby gatunków o działaniu przeciwzapalnym, w tym Bacteroides, Faecalibacterium, Collinsella i Roseburia. Karl i wsp. poprzez analizę próbek kału żołnierzy poddanych długotrwałemu stresowi fizjologicznemu, wykazali pośredni związek między składem mikrobioty jelitowej, stylem życia i funkcją mięśni szkieletowych. Powyższe wyniki badań wydają się potwierdzać istnienie osi jelitowo-mięśniowej [8].
Zdolności antyoksydacyjne organizmu a mikrobiota
Aktywność fizyczna, a także jej brak, wpływają na zwiększone wydzielanie reaktywnych form tlenu. Związki te wpływają na zwiększoną peroksydację lipidów i białek oraz zaburzenie funkcjonowania mięśni. Regularny wysiłek fizyczny prowadzi do zwiększenia aktywności dysmutazy ponadtlenkowej (SOD), katalazy (CAT) i peroksydazy glutationowej (GPx). Dzięki powyższym zmianom dochodzi do zwiększenia możliwości antyoksydacyjnych organizmu.
W jednym z badań wykazano, że produkcja RFT ma pozytywny wpływ na potencjał tlenowy organizmu poprzez aktywację białek PGC-1α, prowadzi to do wzrostu biogenezy mitochondriów a w konsekwencji poprawy wydolności tlenowej. RFT regulują syntezę białek mięśniowych, poprzez wpływ na aktywność kinazy białkowej aktywowanej mitogenami (MAPK), która wspiera insulinopodobny czynnik wzrostu 1 (IGF-1). Nadmierna suplementacja przeciwutleniaczy może zmniejszyć działanie oksydazy cytochromu c i syntazy cytrynianu, przez co dochodzi do upośledzenia funkcji łańcucha transportu elektronów (ETC) [8].
Mikrobiom jelitowy poprzez szczepy o właściwościach antyoksydacyjnych, może przyczyniać się do redukcji stresu oksydacyjnego. W wyniku działania tychże bakterii dochodzi do ekspresji enzymów antyoksydacyjnych, modulacji stanu zapalnego wywołanego przez cytokiny prozapalne lub obecność patogenów, oraz regulacji metabolizmu związanej z większym wchłanianiem przeciwutleniaczy.
Niektóre badania opisują pozytywny wpływ bakterii, Lactobacillus plantarum, Lactobacillus gasseri, Lactobacillus fermentum, Lactococcus Lactis i Streptococcus thermophilus na zwiększenie aktywności SOD. Wykazano również, że wszystkie rodzaje bakterii Lactobacillus, Lactococcus i Bifidobacterium wpływają na zwiększenie poziomu glutationu w jelitach (GSH).
Martatelli i wsp. w swoim badaniu z udziałem sportowców, zaobserwowali, że suplementacja Lactobacillus rhamnosus oraz Lactobacillus paracasei zwiększała poziomy przeciwutleniaczy w osoczu i prowadziła do neutralizacji RFT wytwarzanych w odpowiedzi na wysiłek fizyczny o wysokiej intensywności [8].
Oś jelito-mięśnie
Istnienie osi jelito-mięśnie jest wysoce prawdopodobne. Jednak nie posiadamy w tej chwili badań, które pozwoliłyby na jednoznaczne potwierdzenie istnienia tego fenomenu. Nie istnieją również w tej chwili opracowania na ludziach, które wspierałyby tę tezę, oraz pokazywałyby, jaki jest mechanizm jej działania. Jednak pomimo braku jednoznacznych dowodów, istnieje wiele doniesień świadczących o związku mikrobioty z wydolnością fizyczną osób starszych.
Istnieje wiele badan świadczących o związku pomiędzy występowaniem sarkopenii wśród osób starszych a niekorzystnymi zmianami w obrębie mikrobioty. Doniesienia te wskazują na istnienie osi jelitowo-mięśniowej. W jednym z badań, w którym osobom starszym podawano prebiotyki, potwierdzono związek pomiędzy składem mikrobioty, a występowaniu sarkopenii wśród osób starszych. Jednak w przypadku analizy wpływu mikrobioty, należy uwzględnić szereg czynników środowiskowych.
Wysiłek fizyczny jest jednym z czynników o potencjalnie korzystnym działaniu na skład flory bakteryjnej. Natomiast w przypadku siedzącego trybu życia dochodzi do wzrostu ilości bakterii patogennych. Co za tym idzie dysbiozy jelitowej. Dieta ze względu na swa złożoność jest czynnikiem niezwykle problematycznym. Suplementacja białka, choć jest traktowana jako element terapii w przypadku sarkopenii, może mieć dwojaki skutek. Jak już wcześniej wspomniano, niektóre badania świadczą o takich korzyściach związanych ze zwiększonym spożyciem białka jak: ułatwione trawienie, fermentacja, zwiększony anabolizm, jednak z drugiej strony większość badań świadczy o niekorzystnym wpływie diety wysokobiałkowej na skład mikrobioty jelitowej.
Do jednych z nich należy zmniejszenie ilości bakterii Bifidobacteria, a w konsekwencji wytwarzania maślanu, będącego głównym środkiem przeciwzapalnym oraz mediatorem anabolizmu związanym z osią jelitowo-mięśniową. W konsekwencji może prowadzić do nasilonego katabolizmu mięśniowego [7].
Mikrobiota jelitowa to niezwykle złożony ekosystem. Obecna wiedza na temat różnorodności oraz liczebności składowych mikrobioty, może nie być na tyle szeroka, aby móc wyjaśnić zależności łączące ją z masą mięśniową. Potencjalnie korzystny lub patologiczny wpływ mikroflory na kwestię sarkopenii powinien być tematem przyszłych badań, aby możliwe było stwierdzenie związku łączącego mikrobiotę z masą mięśniową [7].
W świetle obecnego stanu wiedzy wydaje się, że mikrobiota jelitowa może mieć korzystny wpływ na wyniki sportowe. Wpływ flory bakteryjnej na zmiany w działaniu układu immunologicznego, nasilenia stresu oksydacyjnego, procesów metabolicznych i biodostępność składników odżywczych, to główne mechanizmy brane pod uwagę w przypadku związku mikrobioty z adaptacją treningową.
Dotychczasowe badania wykazują zależność pomiędzy mikrobiotą a syntezą białek mięśniowych oraz biogenezą i funkcją mitochondriów, oraz magazynowaniem glikogenu mięśniowego. Zaburzenia w obrębie flory bakteryjnej mogą przyczyniać się zmniejszenia adaptacji fizjologicznej, nasilenia stanu zapalnego, zwiększone wytwarzanie RFT.
Nie pozostaje bez wątpliwości fakt, że suplementacja probiotykami ma wpływ na wydolność tlenową i beztlenową sportowców. Jednak szczegóły tych procesów nie są dobrze poznane i istnieje wyraźna potrzeba dalszych badań w celu sprawdzenia zależność pomiędzy składem mikrobioty, wpływem żywienia charakterystycznego dla dyscypliny sportowej oraz zależności pomiędzy połączeniem jelitowo-mięśniowym z adaptacją tkanki mięśniowej do wysiłku fizycznego [8].
Podsumowanie
Występowanie osi mózgowo-jelitowej było niesamowitym odkryciem. Obecne badania, choć ograniczone co do ilości oraz zgodności wyników, wskazują na występowanie kolejnego fenomenu w ludzkim organizmie. Choć w niektórych opracowaniach potwierdza się istnienie osi jelitowo-mięśniowej, na zgłębienie zależności z nią związanych potrzeba czasu i kolejnych badań.
Jednak warto mieć na uwadze, że dotychczasowe obserwacje świadczą o pewnych zależnościach, choć nie do końca poznanych. Niezwykle duża zmienność osobnicza oraz niewielka ilość badań na sportowcach, wiąże się z potrzebą dalszych obserwacji związku składu mikrobioty z funkcjonowaniem układu mięśniowego.
Licencjonowany dietetyk. Obecnie kontynuuję edukacje na studiach magisterskich na Uniwersytecie Przyrodniczym w Poznaniu. Jestem zwolennikiem zdroworozsądkowego podejścia do żywienia oraz aktywności fizycznej. Moje motto to: „ Świadomość kształtuję twoją rzeczywistość”