Żelazo dla mózgu. O tym, jak żelazo wpływa na nastrój i zdrowie psychiczne

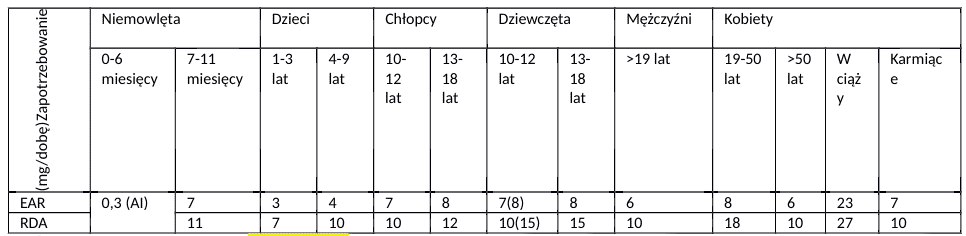
Żelazo to mikroelement powszechnie występujący w żywności pochodzenia roślinnego i zwierzęcego. W związku z tym może zaskakiwać, że jego niedobór jest najczęściej spotykanym deficytem na całym świecie [1,2]. Badania ogólnopolskie wskazują, że dzienne spożycie żelaza wśród mężczyzn i chłopców sięga około 15 mg. U dziewcząt i kobiet wynosi 10,2 mg, a ogółu populacji 12,4 mg [3].
Zapotrzebowanie na żelazo jest zależne od wielu czynników. Należą do nich:
- płeć,
- wiek,
- stanu fizjologiczny.
M.in. u kobiet w wieku produkcyjnym niezbędne jest pokrycie strat wynikających z menstruacji, a kobiet w ciąży potrzeb rozwijającego się płodu, łożyska i zwiększonej masy hemoglobiny [3].
Naturalnie żelazo występuje w 2 stopniach utlenienia:
- Fe2+ (żelazo hemowe; produkty odzwierzęce),
- Fe3+ (niehemowe, produkty roślinne).
Biodostępność tego pierwiastka mieści się w zakresie 10-15% [3]. Lepiej przyswajalną formą żelaza jest żelazo hemowe, którego wchłanianie sięga nawet 20%. Z produktów roślinnych wynosi ono tylko 1-5% [3,4]. Mniejsza biodostępność żelaza niehemowego wynika z konieczności redukcji stopnia utlenienia pierwiastka. Proces ten ma miejsce w kwaśnym środowisku żołądka. Redukcja może zajść także dzięki odpowiedniemu skomponowaniu diety. Korzystny jest dodatek do posiłków witaminy C, lizyny czy zawartego w kiszonkach kwasu mlekowego [5].
Innymi czynnikami wpływającymi na biodostępność żelaza są występujące w żywności związki antyodżywcze tj. fityniany, szczawiany, polifenole, a także wapń, cynk czy białko [3,5]. Ponadto, wchłanianie nasila niski poziom zapasów żelaza w organizmie.
Znaczenie żelaza dla organizmu człowieka
Żelazo występuje w organizmie w niewielkiej ilości (3500-4500 mg). Pomimo to pełni wiele kluczowych ról:
- Jest składnikiem hemoglobiny, mioglobiny, transferyny i wielu enzymów tkankowych.
- Stanowi niezbędny element transportu i magazynowania tlenu.
- Bierze udział w transporcie elektronów (cytochromy).
- Uczestniczy w desaturacji kwasów tłuszczowych.
- Wspomaga rozkład nadtlenku wodoru (katalaza).
- Jest niezbędny do reakcji jodowania tyrozyny (peroksydaza tarczycowa).
- Bierze udział w katabolizmie tryptofanu.
- Jest zaangażowane w biosyntezę prostaglandyn.
- Wspomaga detoksykację szkodliwych substancji w wątrobie (cytochrom P-450).
- Jest niezbędny do syntezy DNA.
- Tworzy czerwone krwinki.
- Uczestniczy w metabolizmie tlenku azotu.
- Stanowi niezbędny element oddychania komórkowego.
- Uczestniczy w zwalczaniu bakterii i wirusów przez układ odpornościowy.
- Wpływa na metabolizm cholesterolu [1,3,4,6].
Niedobór żelaza a stan zdrowia
Niedobór żelaza najczęściej jest wynikiem niewystarczającego spożycia wraz z dietą. Ponadto może powstać w wyniku zaburzeń wchłaniania, krwawień, przewlekłych stanów zapalnych, infekcji, chorób nowotworowych, wrodzonego lub nabytego niedoboru transferyny czy też wrzodów żołądka, dwunastnicy, gruczołkowatego polipa i nadżerkowego zapalenia żołądka [7].
Często występuje u ludzi starszych stosujących leki, tj. leki zobojętniające kwasy, antagoniści H2, inhibitory pompy protonowej, aspiryna i inne NLPZ. Nie obojętny dla zasobów żelaza jest także wszechobecny stres [6]. Najbardziej narażone na jego niedobór są osoby starsze, kobiety w okresie rozrodczym i dzieci [2].
Konsekwencjami niewystarczających zasobów żelaza są:
- Niedokrwistość, objawiająca się: bladością śluzówek, spojówek, zajadami, szorstką skórą, łamliwością włosów i paznokci.
- Obniżenie odporności,
- Zaburzenia rytmu serca,
- Zmęczenie i nasilona męczliwość,
- obniżona zdolność do wysiłku,
- gorsza efektywność pracy,
- zaburzenia termoregulacji,
- nieprawidłowości dotyczące wzrostu organizmu [1–3].
Inne możliwe objawy i konsekwencje nieodpowiedniego spożycia żelaza przedstawia dalsza część artykułu.
Żelazo dla mózgu, czyli jego znaczenie dla naszego nastroju i zdrowia psychicznego
Żelazo odgrywa kluczową rolę w prawidłowej morfologii, neurochemii i bioenergetyce mózgu. Pierwiastek ten oddziałuje na procesy kluczowe dla regulacji nastroju, koncentracji, funkcji poznawczych, czy poziom lęku.

Żelazo oddziałuje na obszary mózgu kontrolujące zachowania, na wewnątrz- i zewnątrzkomórkowe stężenie neurotransmiterów, ich poziom oraz poziom innych istotnych białek. Konsekwencje niedoboru żelaza zależą od wieku, w którym nastąpiła ekspozycja i długości jej trwania. Znaczenie ma także stan zdrowia i odżywienia człowieka, międzypłciowe różnice w metabolizmie tego metalu oraz indywidualna odpowiedź organizmu na stres oksydacyjny. Obszar, w jakim doszło do niewystarczającego dowozu żelaza i interakcje między nim a innymi pierwiastkami to dodatkowe czynniki wpływające na zdrowie psychiczne [1].
Żelazo to najpowszechniej występujący metal przejściowy w mózgu:
- Jest niezbędny do syntezy neurotransmiterów tj. 5-HT (serotonina), noradrenalina i dopamina. Stanowi kofaktor enzymów – hydroksylazy tyrozyny i hydroksylazy tryptofanu.
- Stanowi niezbędny element produkcji mieliny [8].
- Utrzymuje homeostazę glutaminianów i kwasu γ-aminomasłowego (GABA), biorąc udział w przemianach tych związków (oksydaza monoaminowa).
- Wpływa na działanie oksydazy cytochromu c (działanie hipokampa).
Znaczenie niedoboru żelaza na początku życia
Optymalne stężenie żelaza jest szczególnie ważne w czasie rozwoju prenatalnego oraz w pierwszych latach życia. Szybkie magazynowanie tego pierwiastka we wspomnianych okresach odpowiada za prawidłowy rozwój mózgu i może znacząco wpłynąć na organizację behawioralną. Obszary o wysokiej zawartości żelaza są szczególnie wrażliwe na zaburzenie działania substancji tj. dopamina czy GABA. Wspomniane regiony to istota czarna śródmózgowia, gałka blada (kresomózgowie), jądro czerwienne (śródmózgowie) oraz skorupa z jądrem ogoniastym tworzące prążkowie [1].
Konsekwencjami niedoboru żelaza we wczesnych latach są długotrwałe zmiany funkcji behawioralnych, opóźnienie w rozwoju czy zmiany poznawcze. Nieprawidłowości te utrzymują się mimo późniejszej suplementacji żelaza [9]. Dzieci i nastolatkowie borykają się z trudnościami w budowaniu relacji interpersonalnych, zaburzeniami koncentracji uwagi [10]. Gorzej się uczą, cechują je niższe zdolności intelektualne oraz cierpią na zaburzenia funkcji motorycznych. Co więcej, mają wyższy poziom lęku i częściej chorują na depresję [1,11].
Niedobór żelaza u dorosłych
Podobne wnioski zostały wysunięte po obserwacji kobiet w okresie prenatalnym. Niedobór żelaza wiąże się z zaburzeniami funkcji poznawczych, nastroju, niedoborem cynku oraz depresją. Ponadto, kobiety, cierpiące na deficyt tego pierwiastka, wypadają znacznie gorzej w testach dotyczących koncentracji uwagi, uczenia się i pamięci, w porównaniu z grupą kontrolną [11,12].
Żelazo jako składnik krwi i naszego nastroju
Należy pamiętać, że żelazo jest niezbędnym składnikiem hemoglobiny, białka odpowiedzialnego za czerwony kolor erytrocytów. Pierwiastek ten wpływa na wielkość erytropoezy, dostarczanie tlenu do tkanek oraz poziom samej hemoglobiny we krwi. W konsekwencji oddziałuje na nasz nastrój, zdolności intelektualne, męczliwość i zdolność do wysiłku [2,11]. Anemia wiąże się gorszą wydolnością tlenową i wytrzymałościową. Powyższe obserwacje tłumaczą rolę żelaza w zmniejszonej komórkowej pojemności oksydacyjnej.

Zmiany w mózgu – żelazo i nasz nastrój
Niedobór żelaza wiąże się z ograniczeniem procesu mielinizacji i neurotransmisji. Pierwiastek ten ma redukujące właściwości, prowadzące do nasilenia stresu oksydacyjnego, zmian w metabolizmie monoamin oraz homeostazie BDNF [13].
U myszy z niedoborem żelaza obserwuje się zmniejszony poziom serotoniny, norepinefryny (NE), BDNF (brain-derived neurotrophic factor) i jego receptora. Sygnalizacja BDNF wpływa na poziom NE i serotoniny. Powyższe wyniki sugerują, że redukujące właściwości żelaza mogą mieć wpływ na zachowania emocjonalne (pojawienie się lęku).
Żelazo, nastrój a dopamina
Niedobór żelaza wiąże się ze zmniejszeniem gęstości receptorów D2R dla dopaminy w prążkowiu i korze przedczołowej. W konsekwencji dochodzi do zmniejszenia aktywności transportera dopaminy DAT i wzrostu jej stężenia w prążkowiu [14].
Żelazo, nastrój a norepinefryna
Powstanie NE (inaczej – noradrenaliny) jest ściśle związane z działaniem dopaminy. W przypadku niedoboru żelaza aktywność β-hydroksylazy dopaminy (enzymu odpowiedzialnego za przemianę dopaminy w NE) jest o 75% większa. Zmianie ulega także poziom pozakomórkowej NE, który znacząco wzrasta (wewnątrzkomórkowy pozostaje bez zmian) [1].
Żelazo, nastrój a serotonina
Niestety badania nad wpływem żelaza na homeostazę serotoniny dostarczają sprzecznych informacji. 5-HT ma udział w neuro-sygnalizacji decydującej o zachowaniach afektywnych.
Zauważono, że niedobór żelaza wiąże się ze zmniejszeniem gęstości transportera dla serotoniny w prążkowiu oraz ograniczeniem metabolizmu tego neuroprzekaźnika. Uważa się, że zmiany w sygnalizacji serotoniny mogą mieć wpływ na zachowania emocjonalne [15].
Ponadto, obserwacje zmian homeostazy norepinefryny i serotoniny są punktem wyjścia do poniższej teorii.
W sytuacji niedoboru żelaza pierwszorzędny wpływ na struktury mózgowe ma dystrybucja neuroprzekaźników pomiędzy wewnątrz a zewnątrzkomórkowymi przestrzeniami [16].
Żelazo, nastrój a glutaminian i kwas γ-aminomasłowy (GABA)
Niedobór żelaza, zarówno w okresie prenatalnym, jak i po narodzinach, wiąże się ze zmniejszeniem aktywności dekarboksylazy glutaminianowej, dehydrogenazy glutaminianowej i transaminazy 4-aminomaślanowej. Są to enzymy odpowiedzialne za przemiany glutaminianu i GABA [17]. Ponadto, szczury z deficytem tego pierwiastka mają podniesiony poziom glutaminianu i GABA w mózgu. Może to sugerować zwiększoną syntezę tych substancji lub też zahamowanie ich uwalniana z neuronów [18]. Wyższe stężenia GABA, obserwuje się w hipokampie, prążkowiu oraz gałce bladej. Podane obserwacje sugerują nasilenie procesów hamujących ogólną neurotransmisję i aktywność mózgu w sytuacji niedoboru żelaza [18,19].
Żelazo a depresja
Liczne badania potwierdzają istnienie związku między niedoborem żelaza a depresją, zarówno w populacji ogólnej, wśród kobiet ciężarnych, jak i po urodzeniu dziecka (depresja poporodowa)[15,20–23].

Jednakże przyczyną depresji może być niedobór opisywanego pierwiastka lub współwystępowanie deficytu innych składników, tj. cynk czy selen. Możliwe, że depresja jest konsekwencją nieprawidłowego odżywienia organizmu.
A co, gdy żelaza jest za dużo?
Nadmiar żelaza w diecie i zwiększone jego zasoby w organizmie podnoszą poziom reaktywnych form tlenu. Zwiększony stres oksydacyjny prowadzi do uszkodzeń komórek, zaburza sygnalizację dopaminergiczną i funkcje monoamin. Prowadzą to do rozwoju zaburzeń poznawczych, lęku, zmian w nastroju i odczuwania emocji [1]. Poziom żelaza zmagazynowanego w mózgu wzrasta wraz z wiekiem, co wiąże się z ryzykiem rozwoju wielu chorób, m.in. neurodegeneracyjnych. Stopień odkładania się amyloidu tkance mózgowej jest ściśle zależny od ilości żelaza i ferrytyny. Badania wskazują na związek między magazynami żelaza a chorobami tj. Parkinson, Alzheimer, schizofrenia, Huntington [2,8,24–27].
Suplementacja żelaza a nastrój
Zaleca się przyjmowanie preparatów żelaza zarówno w celach zapobiegania powstawania objawów niedoboru, jak i ich zwalczania [23].
Według licznych badań, wśród kobiet i nastolatków z niedoborem żelaza lub anemią, przyjmowanie żelaza znacząco poprawia funkcjonowanie poznawcze, pamięć (w tym werbalną pamięć roboczą), zdolności intelektualne czy koncentrację [11,28]. Obiecujące wyniki badań dotyczą także poziomu lęku czy objawów depresyjnych. Szczególnie ważna jest suplementacja w okresie postnatalnym. Zmniejsza ona ryzyko wystąpienia depresji poporodowej oraz nasilenie jej objawów [11].
Podsumowanie
Badania i opracowania naukowe jednoznacznie wskazują na związek między homeostazą żelaza a zaburzeniami nastroju, lękiem czy depresją. Zauważono wpływ opisywanego pierwiastka na funkcje tj. koncentracja, zdolności intelektualne i motoryczne, pamięć czy funkcjonowanie poznawcze. Żelazo oddziałuje poprzez regulację neuroprzekaźnictwa, poziomu stresu oksydacyjnego czy transportu tlenu do mózgu i mięśni.
Warto podkreślić, że deficyt tego pierwiastka jest szczególnie niekorzystny we wczesnych etapach rozwoju. Im dłużej trwa, tym większe ryzyko powstania permanentnych zaburzeń, zarówno fizjologicznych, jak i behawioralnych. Konieczne jest prowadzenie dalszych badań dotyczących powyższej tematyki.
Bibliografia:
- Kim J, Wessling-Resnick M. Iron and Mechanisms of Emotional Behavior. J Nutr Biochem. listopad 2014;25(11):1101–7.
- Portugal-Nunes C, Castanho TC, Amorim L, Moreira PS, Mariz J, Marques F, i in. Iron Status is Associated with Mood, Cognition, and Functional Ability in Older Adults: A Cross-Sectional Study. Nutrients. 23 listopad 2020;12(11):3594.
- Jarosza M, Rychlik E, Stoś K, Charzewskiej J. Normy żywienia dla populacji Polski i ich zastosowanie. 2020. wyd. Warszawa; 2020.
- Ziemlański Ś. Składniki mineralne. W: Gawęcki J, redaktor. Żywienie człowieka 1 Podstawy nauki o żywieniu. III. Warszawa: Wydawnictwo Naukowe PWN; 2012. s. 223–67.
- Kibil I. Wege. Dieta roślinna w praktyce. i, 6 dodruk wyd. Warszawa: PZWL; 2020.
- Lopresti AL. The Effects of Psychological and Environmental Stress on Micronutrient Concentrations in the Body: A Review of the Evidence. Adv Nutr. styczeń 2020;11(1):103–12.
- Clark SF. Iron deficiency anemia. Nutr Clin Pract. maj 2008;23(2):128–41.
- Nikseresht S, Bush AI, Ayton S. Treating Alzheimer’s disease by targeting iron. Br J Pharmacol. wrzesień 2019;176(18):3622–35.
- Bruner AB, Joffe A, Duggan AK, Casella JF, Brandt J. Randomised study of cognitive effects of iron supplementation in non-anaemic iron-deficient adolescent girls. Lancet. 12 październik 1996;348(9033):992–6.
- Lozoff B, Jimenez E, Hagen J, Mollen E, Wolf AW. Poorer behavioral and developmental outcome more than 10 years after treatment for iron deficiency in infancy. Pediatrics. kwiecień 2000;105(4):E51.
- Lomagno KA, Hu F, Riddell LJ, Booth AO, Szymlek-Gay EA, Nowson CA, i in. Increasing Iron and Zinc in Pre-Menopausal Women and Its Effects on Mood and Cognition: A Systematic Review. Nutrients. 14 listopad 2014;6(11):5117–41.
- Murray-Kolb LE, Beard JL. Iron treatment normalizes cognitive functioning in young women. The American Journal of Clinical Nutrition. 1 marzec 2007;85(3):778–87.
- Texel SJ, Camandola S, Ladenheim B, Rothman SM, Mughal MR, Unger EL, i in. Ceruloplasmin Deficiency Results in an Anxiety Phenotype Involving Deficits in Hippocampal Iron, Serotonin and BDNF. J Neurochem. styczeń 2012;120(1):125–34.
- Meiergerd SM, Patterson TA, Schenk JO. D2 Receptors May Modulate the Function of the Striatal Transporter for Dopamine: Kinetic Evidence from Studies In Vitro and In Vivo. Journal of Neurochemistry. 1993;61(2):764–7.
- Li Y, Kim J, Buckett PD, Böhlke M, Maher TJ, Wessling-Resnick M. Severe postnatal iron deficiency alters emotional behavior and dopamine levels in the prefrontal cortex of young male rats. J Nutr. grudzień 2011;141(12):2133–8.
- Beard JL, Connor JR. Iron status and neural functioning. Annu Rev Nutr. 2003;23:41–58.
- Li D. Effects of iron deficiency on iron distribution and gamma-aminobutyric acid (GABA) metabolism in young rat brain tissues. Hokkaido Igaku Zasshi. maj 1998;73(3):215–25.
- Rao R, Tkac I, Townsend EL, Gruetter R, Georgieff MK. Perinatal iron deficiency alters the neurochemical profile of the developing rat hippocampus. J Nutr. październik 2003;133(10):3215–21.
- Agarwal KN. Iron and the brain: neurotransmitter receptors and magnetic resonance spectroscopy. Br J Nutr. maj 2001;85 Suppl 2:S147-150.
- Dama M, Van Lieshout RJ, Mattina G, Steiner M. Iron Deficiency and Risk of Maternal Depression in Pregnancy: An Observational Study. J Obstet Gynaecol Can. czerwiec 2018;40(6):698–703.
- Hidese S, Saito K, Asano S, Kunugi H. Association between iron-deficiency anemia and depression: A web-based Japanese investigation. Psychiatry Clin Neurosci. lipiec 2018;72(7):513–21.
- Leung BMY, Kaplan BJ. Perinatal depression: prevalence, risks, and the nutrition link–a review of the literature. J Am Diet Assoc. wrzesień 2009;109(9):1566–75.
- Tian Y, Zheng Z, Ma C. The effectiveness of iron supplementation for postpartum depression: A protocol for systematic review and meta-analysis. Medicine (Baltimore). 11 grudzień 2020;99(50):e23603.
- Connor JR, Lee SY. HFE mutations and Alzheimer’s disease. J Alzheimers Dis. listopad 2006;10(2–3):267–76.
- Maaroufi K, Ammari M, Jeljeli M, Roy V, Sakly M, Abdelmelek H. Impairment of emotional behavior and spatial learning in adult Wistar rats by ferrous sulfate. Physiol Behav. 16 luty 2009;96(2):343–9.
- Nandar W, Connor JR. HFE gene variants affect iron in the brain. J Nutr. 1 kwiecień 2011;141(4):729S-739S.
- Rouault TA, Cooperman S. Brain iron metabolism. Semin Pediatr Neurol. wrzesień 2006;13(3):142–8.
- Devaki PB, Chandra RK, Geisser P. Effects of oral iron(III) hydroxide polymaltose complex supplementation on hemoglobin increase, cognitive function, affective behavior and scholastic performance of adolescents with varying iron status: a single centre prospective placebo controlled study. Arzneimittelforschung. 2009;59(6):303–10.
Dietetycy.org.pl » Smart Shopping » Składniki odżywcze » Żelazo dla mózgu. O tym, jak żelazo wpływa na nastrój i zdrowie psychiczne
Magister Dietetyki. Dietetyk, kucharz. Amator zdrowej kuchni, wypieków, biegania oraz swingu.