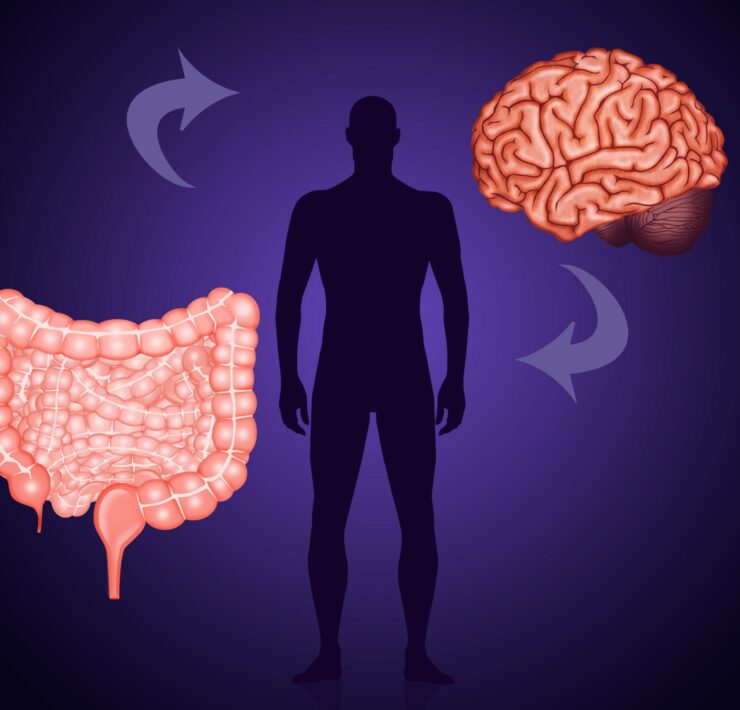
Oś mózg-jelita-mikrobiota

Oś mózgowo-jelitowa
Czy wiesz, że właściwy skład mikroflory jelitowej wpływa na działanie układu nerwowego, a tym samym na Twój nastrój i emocje? Udowodniono, że zespół mikroorganizmów jelitowych wydziela szereg substancji neuroaktywnych, które docierają do mózgu gdzie uczestniczą w kształtowaniu właściwej struktury oraz funkcji obszarów zaangażowanych w kontrolę emocji, aktywność ruchową oraz zdolności poznawcze. Szczepy probiotyczne uszczelniają ścianę jelita i stanowią jeden z elementów bariery jelitowej zabezpieczającej przed przenikaniem mikroorganizmów patogennych i ich metabolitów do krwi, a dalej do układu nerwowego. Jak dowodzą badania naukowe, utrzymując równowagę mikrobiologiczną w jelicie możesz zredukować stres oraz objawy obniżonego nastroju, a nawet agresji.

Połączenie fizyczne i funkcjonalne
Jelito oraz mózg to dwa odległe od siebie organy komunikujące się poprzez oś mózgowo-jelitową [Powell et al., 2017]. Tworzą ją zespół neuronów, w tym nerw błędny, łączący centralny układ nerwowy (CUN) człowieka z przewodem pokarmowym oraz jego gruczołami dodatkowymi tj. trzustką i wątrobą [Udit i Gautron, 2013]. Dwukierunkowe sygnały w osi mogą płynąć drogą nerwową (sygnały neuralne) lub krwionośną (s. biochemiczne) [Mayer, 2011; Mayer i wsp., 2014], a po dotarciu do centralnego układu nerwowego uczestniczyć w kształtowaniu struktury i w konsekwencji funkcji obszarów mózgowia zaangażowanych w kontrolę emocji, aktywność ruchową oraz zdolności poznawcze [Mayer, 2011; Cryan i Dinan, 2012; Foster i McVey Neufeld, 2013; Cryan and O’Mahony, 2011; Bruce-Keller et al., 2015]. Udowodniono już, że tworzenie otoczek mielinowych nerwów kory przedczołowej [Hoban et al., 2016] oraz struktura ciała migdałowatego oraz hipokampu, kluczowych dla przetwarzania emocjonalnego, pozostają pod kontrolą mikrobioty jelitowej [Luczyński et al., 2016].
Czy zaburzenia emocjonalne mogą być wywołane przez dysbiozę?
Z uwagi na istnienie funkcjonalnego połączenia pomiędzy CUN a jelitem, dysbioza może być przynajmniej częściowo odpowiedzialna za rozwój zaburzeń emocjonalnych, w tym depresji. Dlatego przywrócenie równowagi w obrębie mikrobioty jelitowej realizowane poprzez suplementację preparatów probiotycznych/prebiotycznych oraz modyfikację żywienia [Wu et al., 2016] są optymalnym uzupełnieniem tradycyjnej farmako/psychoterapii zaburzeń emocjonalnych. Probiotyki przywracają stan eubiozy w jelicie – komórki bakteryjne obecne w preparacie, namnażają się w jelicie w trakcie jego podawania, co stwarza optymalne warunki do regeneracji własnej, unikatowej dla każdego człowieka mikroflory jelitowej.
Badania kliniczne pokazują, że wybrane preparaty probiotyczne, wpływają na emocje i tym samym zachowanie. Benton i wsp. [2007] przy wykorzystaniu szczepu Lactobacillus casei Shirota w 21 dniowej kuracji u osób zdrowych dowiedli jego udziału w poprawie nastroju. Messaoudi i wsp., [2011] stosując szczepy Lactobacillus helveticus R0052 i Bifidobacterium longum R0175 przez 30 dni w 30 osobowej grupie badanej udowodnili spadek somatyzacji, lęku, intensywności zachowań depresyjnych oraz wskaźnika agresji-wrogości, a także stężenia hormonu stresu-kortyzolu w osoczu. Szczep Bifidobacterium animalis subsp lactis DN-173 010 stosowany przez 28 dni wywołał korzystne zmiany w aktywności obszarów mózgowia odpowiedzialnych za funkcje afektywne [Tillish et al., 2013]. W 2015 roku potwierdzono skuteczność wieloszczepowego preparatu probiotycznego zawierającego Bifidobacterium bifidum W23, Bifidobacterium lactis W52, Lactobacillus acidophilus W37, Lactobacillus brevis W63, Lactobacillus casei W56, Lactobacillus salivarius W24 oraz Lactobacillus lactis W19 i W5 w redukcji negatywnych myśli i smutku. Po 4 tygodniach probiotykoterapii zauważono istotne obniżenie nasilenia zachowań depresyjnych, w szczególności agresji oraz ruminacji definiowanej jako ciągłe wątpliwości co do faktu i jakości wykonywanych czynności. [Steenbergen et al., 2015]. Kolejno, [Allen et al., 2016] szczep probiotyczny Bifidobacterium longum 1714 okazał się pomocny w usprawnianiu pamięci oraz redukcji objawów stresu ocenianych odpowiednio testami poznawczymi oraz testem ochłodzenia rąk.
Co więcej, prebiotyki, a więc fruktooligosacharydy, pochodne galaktozy i β-glukanów oraz laktoferryna [Mojka, 2014], które ulegają fermentacji przy udziale bakterii ekosystemu jelitowego [Van Loo, 2004], mogą wpływać korzystnie na działanie CUN. Wiadomo już, że galaktooligosacharydy (GOS) wpływają korzystnie na plastyczność układu nerwowego [Savignac et al., 2013; Williams et al., 2016] i zmniejszają intensywność stanu zapalnego wywołanego obecnością lipopolisacharydu (endotoksyna bakterii Gram-ujemnych i cyjanobakterii), co konsekwentnie również stabilizuje nastrój [Savignac et al., 2016]. Podobnie laktoferryna, która dodatkowo usprawnia procesy pamięciowe [Chen et al., 2015]. Ponad to, oceniono, że kompleks substancji probiotycznych (GOS, polidekstroza, laktoferyna) wpływa pozytywnie na strukturę mózgowia, zwłaszcza układu limbicznego przetwarzającego wrażenia emocjonalne [Mudd et al., 2016; Waworontu et al., 2016; Williams et al., 2016] oraz ogranicza niekorzystne zmiany w CUN wywołane stresem [Mika et al., 2016].
Bibliografia:
- Allen AP, Hutch W, Borre YE, Kennedy PJ, Temko A, Boylan G, Murphy E, Cryan JF, Dinan TG, Clarke G. Bifidobacterium longum 1714 as a translational psychobiotic: modulation of stress, electrophysiology and neurocognition in healthy volunteers. Transl Psychiatry. 2016;6(11):e939.
- Benton D, Williams C, Brown A. Impact of consuming a milk drink containing a probiotic on mood and cognition. Eur J Clin Nutr 2007;61:355–61.
- Bruce-Keller AJ, Salbaum JM, Luo M, Blanchard E 4th, Taylor CM, Welsh DA, Berthoud HR. Obese-type gut microbiota induce neurobehavioral changes in the absence of obesity. Biol Psychiatry. 2015;77(7):607-15.
- Chen Y, Zheng Z, Zhu X, Shi Y, Tian D, Zhao F, Liu N, Hüppi PS, Troy FA 2nd, Wang B. Lactoferrin Promotes Early Neurodevelopment and Cognition in Postnatal Piglets by Upregulating the BDNF Signaling Pathway and Polysialylation. Mol Neurobiol. 2015;52(1):256-69.
- Cryan JF, Dinan TG. Mind-altering microorganisms: the impact of the gut microbiota on brain and behaviour. Nat Rev Neurosci. 2012;13(10):701-12.
- Cryan JF, O’Mahony SM. The microbiome-gut-brain axis: from bowel to behavior. Neurogastroenterol Motil. 2011;23(3):187-92.
- Foster JA, McVey Neufeld KA. Gut-brain axis: how the microbiome influences anxiety and depression. Trends Neurosci. 2013;36(5):305-12
- Hoban AE, Stilling RM, Ryan FJ, Shanahan F, Dinan TG, Claesson MJ, Clarke G, Cryan JF. Regulation of prefrontal cortex myelination by the microbiota. Transl Psychiatry. 2016;6:e774.
- Luczynski P, Whelan SO, O’Sullivan C, Clarke G, Shanahan F, Dinan TG, Cryan JF. Adult microbiota-deficient mice have distinct dendritic morphological changes: differential effects in the amygdala and hippocampus. Eur J Neurosci. 2016 Nov;44(9):2654-2666. doi: 10.1111/ejn.13291. Epub 2016 Jul 8.
- Mayer EA, Knight R, Mazmanian SK, Cryan JF, Tillisch K. Gut microbes and the brain: paradigm shift in neuroscience. J Neurosci. 2014;34(46):15490-6.
- Mayer EA. Gut feelings: the emerging biology of gut–brain communication. Nat Rev Neurosci. 2011;12(8):453-66.
- Messaoudi M, Lalonde R, Violle N, Javelot H, Desor D, Nejdi A et al. Assessment of psychotropic-like properties of a probiotic formulation (Lactobacillus helveticus R0052 and Bifidobacterium longum R0175) in rats and human subjects. Br J Nutr 2011;105:755–64.
- Mika A, Day HE, Martinez A, Rumian NL, Greenwood BN, Chichlowski M, Berg BM, Fleshner M. Early life diets with prebiotics and bioactive milk fractions attenuate the impact of stress on learned helplessness behaviours and alter gene expression within neural circuits important for stress resistance. Eur J Neurosci. 2016 doi: 10.1111/ejn.13444. [Epub ahead of print]
- Mojka K. Probiotyki, prebiotyki i synbiotyki – charakterystyka i funkcje Probl Hig Epidemiol 2014;95(3):541-9.
- Mudd AT, Alexander LS, Berding K, Waworuntu RV, Berg BM, Donovan SM, Dilger RN. Dietary Prebiotics, Milk Fat Globule Membrane, and Lactoferrin Affects Structural Neurodevelopment in the Young Piglet. Front Pediatr. 2016 Feb 4;4:4.
- Powell N, Walker MM, Talley NJ. The mucosal immune system: master regulator of bidirectional gut-brain communications. Nat Rev Gastroenterol Hepatol. 2017 doi: 10.1038/nrgastro.2016.191.
- Savignac HM, Corona G, Mills H, Chen L, Spencer JP, Tzortzis G, Burnet PW. Prebiotic feeding elevates central brain derived neurotrophic factor, N-methyl-D-aspartate receptor subunits and D-serine. Neurochem Int. 2013;63(8):756-64.
- Savignac HM, Couch Y, Stratford M, Bannerman DM, Tzortzis G, Anthony DC, Burnet PW. Prebiotic administration normalizes lipopolysaccharide (LPS)-induced anxiety and cortical 5-HT2A receptor and IL1-β levels in male mice. Brain Behav Immun. 2016;52:120-31.
- Steenbergen L, Sellaro R, van Hemert S, Bosch JA, Colzato LS. A randomized controlled trial to test the effect of multispecies probiotics on cognitive reactivity to sad mood. Brain Behav Immun. 2015;48:258-64.
- Tillisch K, Labus J, Kilpatrick L, Jiang Z, Stains J, Ebrat B et al. Consumption of fermented milk product with probiotic modulates brain activity. Gastroenterology 2013;144:1394–401
- Udit S, Gautron L. Molecular anatomy of the gut-brain axis revealed with transgenic technolo¬gies: implications in metabolic research. Front. Neurosci. 2013;7:134.
- Van Loo The specificity of the interaction with intestinal bacterial fermentation by prebiotics determines their physiological efficacy. Nutr Res Rev 2004;17(1):89-98.
- Waworuntu RV, Hanania T, Boikess SR, Rex CS, Berg BM. Early life diet containing prebiotics and bioactive whey protein fractions increased dendritic spine density of rat hippocampal neurons. Int J Dev Neurosci. 2016;55:28-33.
- Williams S, Chen L, Savignac HM, Tzortzis G, Anthony DC, Burnet PW. Neonatal prebiotic (BGOS) supplementation increases the levels of synaptophysin, GluN2A -subunits and BDNF proteins in the adult rat hippocampus. Synapse. 2016;70(3):121-4.
- Wu H, Tremaroli V, Bäckhed F. Linking Microbiota to Human Diseases: A Systems Biology Perspective. Trends Endocrinol Metab. 2015;26(12):758-70.
Dietetycy.org.pl » Aktualności » Oś mózg-jelita-mikrobiota
 Strefa dla zalogowanych >
Strefa dla zalogowanych >