Genetyczne uwarunkowania metabolizmu folianów

Foliany jest to grupa związków chemicznych należąca do związków heterocyklicznych. Kwas foliowy jest to inaczej kwas pteroilopoliglutaminowy, zawierającego kwas pterowy oraz 2 do 7 reszty glutaminowe. Aktywność biologiczna folianów jest równa aktywności biologicznej kwasu foliowego. Różnica pomiędzy poszczególnymi związkami należącymi do folianów polega na stopniu utlenienia pierścienia pirydyny oraz ilości reszt kwasu glutaminowego[1].
Metabolizm folianów
W żywności foliany występują pod postacią złożonych związków, poliglutaminowych koniugatów. Związki te są rozkładane w jelicie cienkim do monoglutaminianów przez dekoniugazy poliglutaminowe. Jedynie monoglutamylofoliany mogą być wchłonięte do wnętrza enterocytu. Ostatnia reszta glutaminowa jest odłączana od kwasu pteroilopoliglutaminowego w reakcji hydrolizy. Reakcja ta zachodzi dzięki działaniu enzymu o nazwie karboksypeptydaza glutaminianu II (dekoniugaza), znajdującego się w lizosomach rąbka szczoteczkowego jelita czczego. Wewnątrz komórki monoglutamylofoliany są na nowo syntetyzowane do koniugatnów poliglutaminowych z udziałem syntazy folipoli gamma glutaminianowej(FGCP). Proces ten nazywany jest „pułapką folianową” i uniemożliwia transport folianów na zewnątrz komórki oraz zwiększa ich wewnątrzkomórkowe zapasy [4].
We wnętrzu komórki, kwas foliowy jest przekształcany do dihydrofolianu a następnie w wyniku oddziaływania reduktazy dihydrofolianowej do tetrahydrofolianu. Hydroksymetylotransferaza serynowa przenosi grupę metylenową z łańcucha bocznego seryny na tetrahydrofolian. Powstaje 5,10-metylenotetrahydrofolian i glicyna. Następnie przy udziale reduktazy metylenotetrahydrofolianu (MTHFR) dochodzi do redukcji 5,10-metylenotetrahydrofolioanu do 5-metylotetrahydrofolianu. W dalszej kolejności przy udziale syntazy metioniny oraz witaminy B12 jako kofaktora reakcji, reszta metylowa z 5-metylotetrahydrofolianu jest przenoszona do homocysteiny. W rezultacie powyższej reakcji powstaje metionina oraz tetrahydrofolian [4].
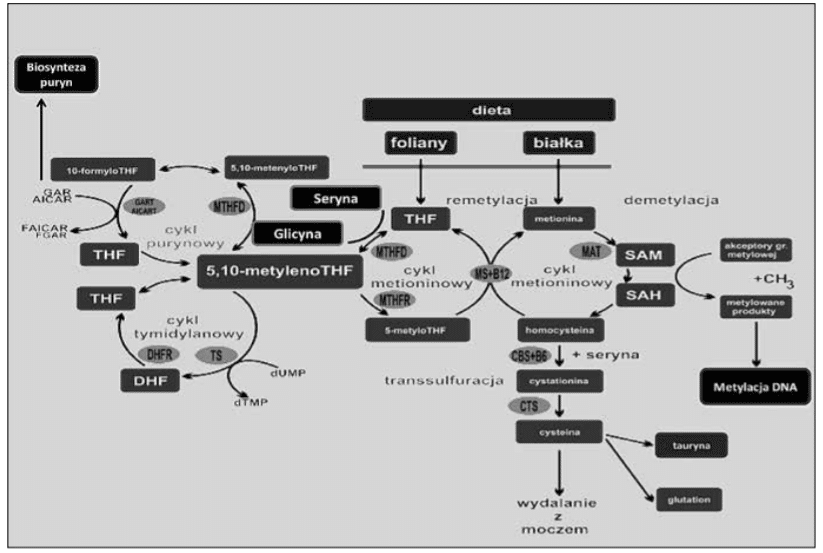
Metionina ulega przemianie do S-adenozylometioniny (SAM). Dzięki przemianie metioniny do SAM dochodzi do aktywacji grupy metylowej. Poprzez proces metylacji SAM jest przekształcana do S-adenozylohomocysteiny (SAH), która następnie jest hydrolizowana do homocysteiny. W wyniku wysokiej dostępności metioniny, dochodzi do zwrotnego hamowania MTHFR. Niska aktywność MTHFR uniemożliwia wytwarzanie 5-metylenotetrahydrofolianu czyli najważniejszej i najbardziej powszechnej formy kwasu foliowego. Brak substratu do wytwarzania metioniny wpływa na wysoki poziom homocysteiny, która uwalniana do krwioobiegu może przyczyniać się do uszkodzenia naczyń krwionośnych [4].
Transsulfuracja homocysteiny
Innym szlakiem przemian homocysteiny jest jej udział w reakcji transsulfuracji. Podczas powyższej reakcji dochodzi do połączenia homocysteiny z seryną przy udziale Beta-syntazy cystationiny, w wyniku czego powstaje cystationina. Do aktywacji syntazy cystationinowej niezbędna jest witamina B6. Cystationina jest redukowana do cysteiny, która następnie bierze udział w syntezie gutationu z wytworzeniem tauryny. Również w tym przypadku dochodzi do zahamowania Beta-syntazy cystationinowej poprzez wysokie stężenie S-adenozylometioniny, co może przyczyniać się do wysokiego poziomu homocysteiny [12].
Transport i wychwyt komórkowy
Za transport zredukowanych form folianów do tkanek odpowiada dwukierunkowy transporter anionów RFC1, pośredniczący we wchłanianiu monoglutamylofolianów z jelita cienkiego i okrężnicy.
Pozostałe metabolity zostają wchłaniane przy udziale receptorów folianowych (FOLRs). FOLR1 jest receptorem o wysokim powinowactwie do folianów. Jest obecny w łożysku, grasicy, płucach, mózgu oraz wątrobie natomiast jego rozpuszczalna forma krąży w krwioobiegu. Jednak jej zastosowanie nie jest do końca poznane. FOLR3 jest receptorem dostępnym w tkankach krwiotwórczych, natomiast FOLR2 powstaje w łożysku w okresie rozwoju płodu. FOLR2 i 3 mają jednak dużo niższe powinowactwo do folianów aniżeli FOLR1 [4].

Fizjologiczne funkcje folianów
Formami folianów o najwyższej aktywności biologicznej są pochodne folianów, zwłaszcza tetrahydrofolian (THF), dihydrofolian (DHF), 5,10-metyleno-THF 5-metylo-THF, 5-formylo-THF, 10-formylo-dihydrofolian, oraz 10-formylo-THF. Każda z nich w pewnym stopniu wpływa na szlak przemian homocysteiny do metioniny.
Najistotniejszą rolą folianów, jest ich udział w metabolizmie grup jednowęglowych. Zaliczamy do nich grupy metylowe, metylenowe, metylidenowe, formylowe oraz formimidolowe. Foliany mają również swój udział w przemianie histydyny do kwasu glutaminowego oraz seryny do glicyny. Foliany uczestniczą w metylacji DNA poprzez swój udział w metabolizmie grup jednowęglowych, syntezie kwasów nukleinowych, zasad purynowych oraz pirymidynowych oraz w reakcjach umożliwiających syntezę DNA. Dzięki folianom możliwa jest również synteza fosfolipidów i nukleotydów oraz synteza i metylacja białek [1].
Zawartość w żywności
Foliany są związkami, które człowiek musi dostarczać z żywności i to właśnie w żywności znajdują się największe ilość folianów. Jedynie niewielkie ilości kwasu foliowego są syntetyzowane w jelitach przy udziale mikroflory jelitowej. Największe ilości znajdują się w warzywach. W szczególności są to warzywa liściaste i ciemnozielone, kapustne (jarmuż, sałata, kapusta, brokuły) oraz suche nasiona roślin strączkowych. Zwierzęcymi źródłami folianów są : wątroba, jaja oraz mięso i sery dojrzewające [1].
Foliany występujące w żywności, należą do związków rozpuszczalnych w wodzie. Należą również do jednych z bardziej niestabilnych związków. Zmniejszona zawartość folianów w żywności, może być spowodowana działaniem wysokiej temperatury, dostępnością tlenu oraz promieniowania słonecznego. Ich trwałość ulega zmniejszeniu w przypadku obojętnego i kwaśnego pH. Absorpcja w jelicie jest ograniczona i jest nie większa niż 50%. Biodostępność folianów jest również związana z ich żródłem i jest znacznie niższa dla źródeł roślinnych w porównaniu do źródeł zwierzęcych. Analizy spożycia folianów w Polsce wskazują na zbyt niskie spożycie tej witaminy [1].
Zapotrzebowanie na foliany
Ludzki organizm potrafi kumulować foliany pod postacią kwasu foliowego głównie w wątrobie, w której to znajduje się połowa zapasów tego związku. Ogólnoustrojowe zapasy kwasu foliowego wynoszą od 5 do 10mg. Prawidłowe stężenie kwasu foliowego w surowicy mieści się w granicach od 6 do 20 ng/ml, natomiast w erytrocytach w granicach od 160 do 640ng/ml. Poniżej powyższych norm, stwierdza się niedobór folianów mogący wpływać na zdrowie człowieka.
Oprócz dostępności biologicznej oraz ilości spożywanych folianów, istotną kwestia mogącą wpływać na poziom tej witaminy są choroby oraz stosowane leki. Do chorób wpływających na zapotrzebowanie na foliany, należy zaliczyć: choroby przewodu pokarmowego, w tym choroby przebiegające z przewlekłym stanem zapalnym jak również niewydolność trzustki w przypadku chorób wątroby czy niedokrwistość hemolityczną, choroby nowotworowe i okres rekonwalescencji. Lekami wpływającymi na upośledzone wchłanianie folianów z przewodu pokarmowego są leki przeciwzapalne, przeciwpadaczkowe, niektóre środki antykoncepcyjne, antymalaryczne oraz barbiturany.
Lekiem który hamuję przemianę dihydrofolianu do tetrahydrofolianu na drodze inhibicji kompetencyjnej jest metotreksat. Do produktów negatywnie wpływających na wchłanianie folianów, należy również zaliczyć alkohol i papierosy.
Zapotrzebowanie na foliany wzrasta w okresie ciąży i laktacji, jest również uzależnione od wieku oraz dostępności witamin z grupy B. Kobiety w ciąży ze względu na zwiększone zapotrzebowanie, powinny suplementować kwas foliowy w postaci syntetycznej w ilości 0,4mg/dobę [1,2,17].
Tabela nr.1 Rekomendacje dotyczące spożycia folianów dla populacji polskiej [opracowanie na podstawie Norm żywienia dla populacji polskiej z 2017 roku]
Genetyczne uwarunkowania metabolizmu folianów
W tej chwili istnieje dość duża liczba badań dotycząca zależności pomiędzy spożyciem folianów, genotypem a zawartością folianów w organizmie. Ze względu na zależność pomiędzy deficytem kwasu foliowego w organizmie a ryzykiem wystąpienia wady rozwojowej cewy nerwowej oraz innych wad wrodzonych u dziecka istnieje wiele opracowań poświęconym wpływowi powyższych zależności na organizm kobiet w ciąży. Zwiększone stężenie homocysteiny u osób z niskim spożyciem folianów, jest często wiązane ze zwiększonym ryzykiem chorób układu krążenia, nowotworów i pogorszeniem funkcji poznawczych.
RFC1
Jak już wcześniej wspomniano za transport folianów odpowiedzialny jest nośnik RFC1. Polimorfizm (rs1051266), genu kodującego powyższe białko charakteryzuje się występowaniem glicyny w pozycji alaniny. Niektóre badania pokazują, że zmiana ta może mieć wpływ na transport folianów. W związku z powyższym, wśród dzieci matek spożywających małe ilości kwasu foliowego może dojść do rozszczepu kręgosłupa [4].
Receptory folianowe (FOLRs)
Polimorfizmy decydujące o aktywności receptora folianowego 1, umiejscowione są przy nukleotydach : 762, 631 oraz 610. W wyniku różnic w powyższych wariantach genu kodującego FOLR1 może dojść do zmniejszonego wchłaniania folianów do łożyska. Podobnie wygląda kwestia zaburzonego wchłaniania folianów, w przypadku wariantu 254A>G genu kodującego receptor FOLR2. W obu przypadkach może dojść do zaburzenia tworzenia cewy nerwowej oraz powstawania wad wrodzonych [4].
Karboksypeptydaza glutaminowa II
Powszechnie występujący polimorfizm 475H>Y (rs61886492) wpływający na aktywność enzymu karboksypeptydazy glutaminianu II, może wpływać na zmniejszone wchłanianie folianów z pożywienia. Jednak jak pokazują dotychczasowe badania, nie przyczynia się to do zmniejszonego stężenia folianów we krwi oraz wchłaniania kwasu foliowego czyli syntetycznej formy folianów. Nie zaobserwowano również wpływu powyższego polimorfizmu, na działanie syntazy folipoli gamma glutaminianowej(FGCP) wewnątrz komórki[4,5,6].
Reduktaza dihydrofolianowa
Kolejnym istotnym enzymem zaangażowanym w metabolizm folianów, na którego działanie wpływają polimorfizmy kodujących go genów jest reduktaza dihydrofolianowa. Obecnie zidentyfikowano 4 polimorfizmy, dotyczące powyższego genu. Jeden z nich polega na delecji w intronie 1 (rs79950164), w wyniku czego dochodzi do zmniejszenia ekspresji reduktazy dihydrofolianu. Polimorfizm ten jest wiązany z 52% wzrostem ryzyka wystąpienie raka piersi w przypadku osób suplementujący preparaty zawierające kwas foliowy przez długi okres czasu [4].
Reduktaza metylenotetrahydrofolianowa
Genem który w największym stopniu jest wiązany z zaburzeniami metbolizmu folianów, jest gen kodujący reduktazę metylenotetrahydrofolianową (MTHFR). Najbardziej rozpowszechnionym polimorfizmem, jest wersja genu w której w pozycji 677 następuje zamiana cytozyny na tyminę. W wyniku tej zamiany, dochodzi do wbudowania waliny w miejscu alaniny, w sekwencji łańcucha białkowego enzymu. Wersja ta charakteryzuję się mniejszą aktywnością enzymatyczną, ze względu na mniejszą stabilność. Wśród nosicieli genotypu TT(677C>T) obserwuję się aktywność zmniejszoną do poziomu 30%, natomiast wśród nosicieli genotypu CT aktywność enzymu ograniczona jest do 60%. W przypadku genu MTHFR, odnotowano znacznie więcej występujących polimorfizmów. Przykładem mogą być wariant 1298A>C wpływający na zwiększoną syntezę SAM, a co za tym idzie zmniejszają aktywność MTHFR. Polimorfizm 1793G>A może wpływać na zmniejszoną stabilność i aktywność MTHFR, jednak jego występowanie jest znacznie rzadsze niż pozostałych polimorfizmów [7].
Syntaza metioniny
Syntaza metioniny jest enzymem odpowiedzialnym za przenoszenie grupy metylowej z 5- metylenotetrahydrofolianu na homocysteinę z uwolnieniem tetrahydrofolianu, o czym wspomniano już we wcześniejszej części artykułu. Syntaza metioniny zawiera w sobie kobalaminę, dlatego wśród kobiet z niskim poziomem witaminy B12 w osoczu stwierdzono kilkakrotnie wyższe ryzyko występowania wad rozwojowych płodu. Do tej pory odkryto 12 wariantów genu kodującego powyższy enzym. Wariant genu 2756A> G (rs1805087) charakteryzuje się zamianą nukleotydu zawierającego adanine na guaninę, w pozycji 2756 eksonu 26. Wariant ten może wpływać na zwiększenie ryzyka sercowo naczyniowego, hiperhomocysteinemii oraz zwiększone ryzyko upośledzenia płodu [4,9].
Kwestia genetycznych uwarunkowań metabolizmu folianów, jest znacznie szersza aniżeli ta przedstawiona powyżej. W poniższej tabeli zobrazowano dotychczasowe doniesienia związane z polimorfizmami genetycznymi metabolizmu folianów oraz ich potencjalny wpływ na organizm człowieka.
Tabela nr.2 Polimorfizmy genetyczne związane z metabolizmem folianów oraz ich potencjalny wpływ na zdrowie człowieka [opracowanie na podstawie źródeł: 4,12]
Czynniki zewnętrzne wpływające na wchłanianie folianów
Istotną kwestią w przypadku oceny spożycia folianów, jest ich biodostępność. Kwestia ta zależna jest od wielu czynników m. in. rodzaju produktu. Foliany należą do witamin rozpuszczalnych w wodzie. Ich stabilność jest bardzo niska. Natomiast straty w trakcie przygotowania sięgają 50%-80%, całkowitej zawartości w spożywanych warzywach i owocach. Ze względu na występowanie kowalencyjnych połączeń pomiędzy folianami a makrocząsteczkami w produktach pochodzenia roślinnego, ich absorpcja z tychże produktów jest zdecydowanie niższa.
Na wchłanianie folianów, ma również wpływ zawartość innych substancji w żywności. Askorbinian i białka wiążące foliany wpływają na stabilizację folianów poprzez tworzenie związków, zapewniających przejście tych witamin do jelita. Dzięki temu procesowi foliany transportowane są do jelita, gdzie w wyniku działania karboksypeptydazy glutaminowej II są rozkładane do monoglutamylofolianów i wchłaniane do enterocytów. Czynnikiem ograniczającym działanie powyższego enzymu, może być nieprawidłowe pH w jelicie. Jak pokazują badania soki owocowe: pomarańczowy lub pomidorowy ze względu na zawartość cytrynianu, askorbinianu oraz malonianu mogą hamować działanie enzymu. Co w dalszej kolejności przyczynia się do zmniejszonego wchłaniania folianów z jelita [10].
Istotną kwestią w przypadku zapewnienia lepszej wchłanialności folianów, jest dostarczenie witamin i minerałów, będących kofaktorami reakcji pozwalających na wchłanianie folianów do wnętrza komórki. W przypadku planowania żywienia nastawionego na zwiększenie dostępność omawianych związków, warto zwrócić uwagę na witaminę B12, witaminę C, oraz żelazo i cynk. Niedobory folianów są wywołane przez wiele czynników m. in. środowiskowych, ogólnoustrojowych i genetycznych. Mała biodostępności folianów występujących w pożywieniu oraz ich niska stabilność podczas obróbki termicznej, utrudnia realizację zapotrzebowania.
Syntetyczna forma folianów charakteryzuję się dużo większą biodostępnością, stopień przyswajalności na czczo określa się na 100%. Jego stabilność oraz biodostępność jest dużo wyższa niż folianów zawartych w żywności. Ponadto wchłanianie kwasu foliowego trwa krócej niż jego naturalnie występujących odpowiedników. Kwas foliowy możemy spotkać pod postacią suplementu lub w produktach fortyfikowanych kwasem foliowym [10,11].
Należy jednak zauważyć, że podstawowym źródłem folianów dla człowieka powinny być produkty pochodzenia naturalnego. Natomiast postać syntetyczna zalecana jest do stosowania przez osoby, które nie są w stanie zrealizować zapotrzebowania na powyższa witaminę ze względu na niezależne od nich czynniki.
Skutki niedoboru folianów w organizmie człowieka
Metabolizm grup jednowęglowych ma wpływ na funkcjonowanie układu krwiotwórczego, nerwowego oraz sercowo- naczyniowego. Jednym z ważniejszych i bardziej przebadanych powikłań związanych z metabolizmem folianów jest występowanie nawracających poronień, stan przedrzucawkowy, hipotrofia płodu, zgon wewnątrzmaciczny, przedwczesne oddzielenie łożyska, przedwczesny poród, zespół Downa, rozszczep kręgosłupa oraz powstawanie przepukliny mózgowo-rdzeniowej.
Hiperhomocysteinemia
W wyniku zaburzeń wcześniej omówionego metabolizmu folianów może dojść do podniesienia się poziomu homocysteiny w osoczu. Mamy wtedy do czynienia z hiperhomocysteinemią. Wysoki poziom homocysteiny, jest w dużej mierze związany z chorobami układu krwionośnego jak nadciśnienie tętnicze, zawał serca, udar mózgu. Mechanizm działania homocysteiny na naczynia krwionośne jest związany z uszkodzeniem i upośledzeniem funkcji komórek śródbłonka, spadkiem stężenia tlenku azotu oraz zaburzeniem możliwości rozszerzania się tętnic. Homocysteina wpływa również na peroksydację lipidów zawartych we frakcji LDL cholesterolu, aktywację leukocytów oraz ich przenikanie do ściany naczyń krwionośnych, szybsze wytwarzanie makrofagów a w rezultacie na podniesienia się poziomu stresu oksydacyjnego oraz przewlekłego stanu zapalnego również w obrębie mięśni gładkich[12].
Kolejną kwestią na którą warto zwrócić uwagę jest wpływ wysokiego poziomu homocysteiny na choroby neurodegenracyjne i psychiczne. Za powstawaniem tych chorób może stać pogłębianie zmian związanych z wytwarzaniem blaszki miażdżycowej w naczyniach mózgu. W chorobie Alzheimera, Parkinsona, schizofrenii, depresji oraz w otępieniu starczym obserwuje się przyśpieszenie starzenia komórek i zburzenie syntezy neuroprzekaźników, indukcję apoptozy oraz występowanie procesów neurotoksycznych, co może być związane z działaniem homocysteiny [12].
Gromadzenie się homocysteiny w obrębie naczyń okołomacicznych, może przyczyniać się do arteriosklerozy wymienionych naczyń, zakrzepicy oraz niewydolności łożyska. Wszystkie te powikłania, mogą przyczyniać się do działania cytotoksycznego oraz wystąpienia wad cewy nerwowej. W przypadku kobiet w ciąży z hiperhomocysteinemią obserwuję się występowanie poronień nawracających, stanu przedrzucawkowego, hipotrofii płodu, obumarcia wewnątrzmacicznego, przedwczesnego oddzielenia łożyska oraz przedwczesnego porodu [12].
Zaburzenia syntezy DNA
Zaburzenia w cyklu przemian folianów, przekładają się na przenoszenie grup jednowęglowych. Grupy te mają swój istotny wkład w syntezę puryn i pirymidyn, niezbędnych do syntezy DNA. Zaburzenie syntezy DNA w okresie wczesnego rozwoju zarodka, może przyczyniać się do niezamknięcia cewy nerwowej, bezmózgowia, przepukliny mózgowo-rdzeniowej oraz rozszczepu kręgosłupa. W powyższych zaburzeniach upatruję się podłoża genetycznego a dokładnie wpływu polimorfizmów 401G>A, 878G>A, 1958G>A genu MTHFD1(dehydrogenazy metylenotetrahydrofolianowej). Jednak wpływ ten wymaga dalszych badań [12].
Nowotwory
Badania dotyczące wpływu suplementacji kwasu foliowego na proces karcenogenezy, wykazują zależność pomiędzy zastosowaną dawką a stadium nowotworu. Zauważalne efekty suplementacji kwasem foliowym zanotowano jedynie przed wytworzeniem się ognisk neoplastycznych. Zauważono również pozytywny związek pomiędzy suplementacją kwasem foliowym w późniejszych stadiach nowotworu a nasileniem procesu nowotworzenia [11].
Grupy wysokiego ryzyka
Do osób u których suplementacja kwasem foliowym, może znaleźć uzasadnienie należy jako pierwszą zaliczyć kobiety planujące ciążę oraz będące w ciąży. Kobiety planujące ciąże powinny przyjmować 400 µg kwasu foliowego na co najmniej miesiąc przed planowanym zapłodnieniem oraz kontynuować ją do 3 miesiąca ciąży włącznie. Istnieją sugestie, że suplementacją kwasem foliowym powinna obejmować wszystkie kobiety w wieku rozrodczym między 20 a 25 rokiem życia. Autorzy publikacji uzasadniają to deficytem w spożyciu folianów w żywności w analizowanej populacji [11].
Osoby z wysokim poziomem homocysteiny to kolejna grupa, w której sugerowana jest suplementacja kwasem foliowym. Ze względu na szlaki przemian homocysteiny, żywienie osób znajdujących się w tej grupie powinno być zbilansowane zarówno pod kątem zawartości folianów w diecie, jak i kofaktorów reakcji umożliwiających przemiany homocysteiny do metioniny lub cystationiny. Mowa tu o witaminie B6 oraz B12 [11].

Ze względu na upośledzone wchłanianie folianów z przewodu pokarmowego do grupy ryzyka zalicza się również osoby starsze. Wśród tej grupy ludności często obserwuję się, wysoki poziom homocysteiny oraz występowanie anemii megaloblastycznej [11].
Grupą wśród której w 80% przypadków stwierdza się niedobór kwasu foliowego, są osoby uzależnione od alkoholu. W wyniku wysokiego spożycia alkoholu, dochodzi do zwiększonego wydalania wielu składników z moczem. Długotrwałe spożycie alkoholu, jest związane ze zmniejszonym poziomem kwasu foliowego w organizmie, wysokim poziomem homocysteiny, alkoholową chorobą wątroby oraz niedokrwistością megaloblastyczną. Wchłanianie folianów ulega normalizacji po 1-2 tygodniowym odstawieniu alkoholu połączonym z spożywaniem rekomendowanej ilości folianów w diecie[11].
Niealkoholowa stłuszczeniowa choroba wątroby (NAFLD)
Niealkoholowa stłuszczeniowa choroba wątroby, jest jednostką chorobowa o niewyjaśnionej genezie, polegającą na kumulowaniu się nadmiernych ilości tłuszczu w wątrobie. Jednak dotychczasowe badania wykazują korelacje pomiędzy występowaniem NAFLD a otyłością i zespołem metabolicznym. Choroba ta często współwystępuje z insulinoopornościa, cukrzycą typu 2 oraz dyslipidemią. Jednak istnieją również przypadki u osób z prawidłową masą ciała. Naukowcy potwierdzają związek pomiędzy występowaniem NAFLD a jakością diety oraz poziomem aktywności fizycznej. Jak już wspomniano jest to choroba o niepoznanej patogenezie, której powstania dopatruję się w wielu czynnikach. W przypadku niniejszego opracowania, warto przytoczyć kwestie wpływu deficytu folianów na stres oksydacyjny w wątrobie. Proces ten może przyczynić się do wystąpienia NAFLD. Istnieje kilka potencjalnych mechanizmów wpływających na powyższe zależności.
Ze względu na brak folianów wykorzytwanych w przemianach homocysteiny, zostają wykorzystane betaina oraz cholina. Zmniejszony poziom choliny, może przyczyniać się do stłuszczenia wątroby. Zmniejszenie poziomu folianów, może przyczyniać się do zwiększonej ekspresji genów odpowiadających za lipogenezę.
Kolejnym potencjalnym mechanizmem uwikłanym w związek pomiędzy niedoborem folanów w diecie a NAFLD, jest uczestnictwo tetrahydrofolianu w wytwarzaniu S-adenozylometioniny. Ta z kolei uczestniczy w wytwarzaniu fosfatydylocholiny oraz wydzielaniu frakcji VLDL cholesterolu przez wątrobę. Radziejewska i wsp. w opracowaniu dotyczącym zależności pomiędzy metabolizmem grup jednowęglowych a występowaniem NAFLD stwierdzili, że istnieje związek pomiędzy deficytem folianów w organizmie a występowaniem powyższej choroby [13].
Metabolizm tłuszczów a foliany
Związek pomiędzy metabolizmem tłuszczy a folianami, opiera się na powiązaniu metabolizmu folianów z poziomem homocysteiny oraz peroksydacją lipidów zawartych w frakcji LDL cholesterolu. Niektóre opracowania podają że u osób chorych na cukrzycę, częściej występuje polimorfizm c.677>T genu MTHFR. Zaobserwowano również podobną korelację, w przypadku otyłych osób ze zwiększonym poziomem aminotransferazy alaninowej oraz aminotrransferazy asparaginowej czyli enzymów będących markerami wykorzystywanymi w ocenie funkcjonowania wątroby. W jednym z badań zaobserwowano również związek, pomiędzy deficytem folianów i zmniejszonym poziomem ApoE w wyniku czego dochodzi do zwiększonej ekspresji MTHFR oraz syntazy metioninowej. Co jak stwierdzają autorzy świadczy o kompensacyjnej regulacji cyklu metioninowego poprzez zwiększoną ekspresję MTHFR i syntazy metioninowej [14].
Niedokrwistość megaloblastyczna
Podczas procesu erytropoezy zachodzącego w szpiku kostnym, kwas foliowy jest wbudowywany do erytroblastów. Przy deficycie kwasu foliowego, dochodzi do upośledzenia wytwarzania erytrocytów. W wyniku tego powstają duże, niedojrzałe krwinki czerwone, co jest określane jako niedokrwistość megaloblastyczna. Powyższa jednostka chorobowa współwystępuje w takich stanach chorobowych jak zespoły złego wchłaniania, choroba Leśniewskiego-Crohna, wrzodziejące zapalenie jelita grubego czy celiakia. Wszystkie te jednostki chorobowe, przebiegają ze stanem zapalnym jelit. Zwiększone występowanie niedokrwistości megaloblastycznej, obserwowane jest również u kobiet w ciąży, leukemii, chorobach wątroby, stanach padaczkowych oraz w przypadku stosowania niektórych leków. Wszystkie wymienione stany są związane ze zwiększonym zapotrzebowaniem na kwas foliowy[15].
Skutki nadmiernego spożycia/ suplementacji folianów
Spożycie folianów w żywności, uznaję się za bezpieczne a możliwość ich przedawkowania jest wysoce mało prawdopodobna. Wpływ na to mają czynniki omówione w akapicie dotyczącym biodostępności tych witamin. Inaczej kwestia ma się w przypadku suplementów diety zawierających kwas foliowy. Jak już wcześniej wspomniano, suplementacja kwasu foliowego w okresie rozwoju nowotworu może przyczynić się do nasilenia choroby. Istnieją również doniesienia o wpływie nadmiernego spożycia folianów na zwiększone ryzyko występowania nowotworów. Nadmierna podaż kwasu foliowego, może również maskować niedobór witaminy B12, występujący u 10-15% osób po 60 roku życia. W przypadku długotrwałego stosowania może wywoływać to nieodwracalne zmiany neurologiczne a co za tym pogorszenie funkcji poznawczych [1,15].
Polimorfizmy genetyczne metabolizmu folianów a ich poziom w organizmie
Jak już wielokrotnie wspominano, istnieje wiele polimorfizmów oddziaływujących na metabolizm folianów. Jednak jako ten najbardziej istotny zaznacza się polimorfizm genu MTHFR c.677>T. Istnieje wiele doniesień, że to waśnie on w połączeniu z niskim spożyciem folianów w największym stopniu przyczynia się do zwiększonego stężenie homocysteiny w organizmie.
W Chinach sprawdzano wpływ suplementacji kwasu foliowego na poziom folianu w krwinkach czerwonych oraz stężenia homocysteiny w osoczu, w zależności od podawanej dawki suplementu oraz genotypu uczestników. W badaniu wzięło udział 932 uczestników. Badani przyjmowali 100, 400 lub 4000 μg kwasu foliowego/dobę lub pojedynczą dawkę w wysokości 4000μg kwasu foliowego/tygodniowo. Po 3 oraz 6 miesiącach od zaprzestania suplementacji, sprawdzano badane parametry u wszystkich uczestników. W każdym przypadku poziom folianu w RBC uległ podwyższeniu, natomiast poziom homocysteiny uległ obniżeniu. Niezależnie od stosowanej dawki suplementu, obserwowano jednak zmniejszone stężenie folianów w RBC oraz wyższe stężenie homocysteiny u osób z genotypem c.677>T w porównaniu do pozostałych genotypów.
W kolejnym badaniu sprawdzano wpływ suplementacji różnych dawek kwasu foliowego (0,200 i 400 μg) po 30 dniach od jej zaprzestania. Grupa uczestników była znacząco mniejsza i wynosiła 142 osoby. Wzrost stężenia folianów po zastosowanej suplementacji, zaobserwowano niezależnie od genotypu. Po spożyciu 400μg kwasu foliowego, najistotniejszy wzrost nastąpił w grupie z polimorfizmem c.677>T. W jednym z badań sprawdzano wpływ suplementacji kwasu foliowego na stężenie folianów w RBC oraz poziom homocysteiny, w zależności od polimorfizmu genetyczengo różnych genów związanych z metabolizmem folianów (MTHFR c.677>T, MTHFR 1298A>C, MTR 2756A>G i SLC19A1 A80G). Badanie obejmowało 100 japońskich kobiet. Okazało się, że w związku z suplementacją 400μg kwasu foliowego trwająca 4 tygodnie, początkowe wartości stężenia folianów w RBC oraz poziomu homocysteiny uległy korzystnej zmianie. Różnice w początkowym poziomie powyższych substancji zostały wyeliminowane u osób z polimorfizmem c.677>T. W pozostałych przypadkach nie zaobserwowano takich wyników [16].
Żywienie w przypadku polimorfizmu genu MTHFR
Przytoczone w powyższym paragrafie badania, wskazują na niwelowanie potencjalnie negatywnych skutków polimorfizmu c.677>T, poprzez dostarczenie do organizmu kwasu foliowego w ilości 400 μg na dobę. W projekcie zrealizowanym przez władze miasta Sakado i Kagawa Nutrition University w Japonii, w latach 2006-2015 wzięło udział 836 osób. Wśród uczestników przeprowadzono edukację żywieniową, dotycząca konsumpcji folianów w żywności. Natomiast osoby z genotypem c.677>T zostały poinformowane o konieczności zwiększonego spożycia folianów ze względu na uwarunkowania genetyczne. Po 4 i 12 miesiącach od rozpoczęcia interwencji, wśród wszystkich uczestników zaobserwowano wyraźny wzrost poziomu folianów w RBC oraz zmniejszonego poziomu homocysteiny w osoczu. Największe zmiany w badanych parametrach zaobserwowano u osób z genotypem c.677>T. Notowali oni znacznie wyższe spożycie zielonych warzyw oraz żywności fortyfikowanej kwasem foliowym [16].
Rekomendacje dotyczące wartości diagnostycznej genu MTHFR
Polimorfizmy genetyczne odpowiadające za metabolizm folianów, pełnią ważną role w utrzymaniu właściwego ich stężenia w RBC oraz osoczu. Jak już wielokrotnie podkreślano w niniejszym opracowaniu, wpływ ten jest oczywisty. Jednak zaniżony poziom folianów w RBC oraz osoczu, najczęściej wiąże się również ze zbyt niskim spożyciem folianów w żywności lub brakiem suplementacji w grupach o zwiększonym zapotrzebowaniu. Ze względu na możliwa nadinterpretację wartości diagnostycznej polimorfizmów genetycznych a w szczególności najczęściej badanego polimorfizmu genu MTHFR w 2017 roku członkowie Polskiego Towarzystwa Genetyki Człowieka i Polskiego Towarzystwa Ginekologów i Położników opublikowali oficjalne stanowisko w sprawie omawianego tematu. We wspomnianym dokumencie stwierdza się małą wartość diagnostyczną w przypadku szacowania ryzyka nawracających poronień, urodzenia dziecka z wadą rozwojową ośrodkowego układu nerwowego, aberracjami chromosowymi, ryzykiem wystąpienia zakrzepicy, udarów niedokrwiennych mózgu, choroby wieńcowej, wybranych chorób afektywnych, zaburzenia rozwoju psychosomatycznego i niepełnosprawności intelektualnej lub niektórych chorób nowotworowych. Co ciekawe eksperci nie zaobserwowali związku pomiędzy wysokim poziomem homocysteiny wpływającym na wyżej wymienione choroby a występowaniem polimorfizmu genu MTHFR c.677>T [17].
Podsumowanie
Nie ulega wątpliwości, że foliany są istotnymi dla funkcjonowania organizmu witaminami. Natomiast ich spożycie jest gwarancją prawidłowego funkcjonowania wielu szlaków metabolicznych. Głównym obiektem badan nad folianami jest ich wpływ na poziom homocysteiny oraz związane z tym jednostki chorobowe. Istnieją również opracowania dotyczące związku pomiędzy spożyciem folianów a funkcjonowaniem wątroby, metabolizmem tłuszczy oraz uszczupleniem zapasów choliny. Polimorfizmy genetyczne mogą przekładać się na niedobór aktywnych form folianów oraz na poziom homocysteiny w organizmie. Jednak do tej pory, nie zaobserwowano jednoznacznego związku między występującymi polimorfizmami a jednostkami chorobowymi wywoływanymi przez wysoki poziom homocysteiny. Pomimo dotychczasowych doniesień pewną jest kwestia potrzeby dalszych badań, które rozwijać będą temat polimorfizmów genetycznych oraz ich wpływu na zdrowie człowieka. Zgodnie z obecnymi opracowaniami, deficyt folianów w diecie należy uznać jako najważniejszy czynnik występowania zaburzeń w metabolizmie homocysteiny oraz konsekwencji z tym związanych.
Bibliografia
- Jarosz. M., i wsp., Normy żywienia dla populacji Polski. (2017).Instytut żywności i Żywienia.
- Appleton, Vanbergen. Metabolizm i żywienie. Crash Course. (2015) Wydanie 4. Edra Urban & Partner
- Konrad Biesalski H. i Grimm P., Żywienie Atlas i Podręcznik.(2012).Elsevier. Urban & Partner
- Martin Kohlmeier. Nutrients metabolism.(2015) . Academic Press
- Afman LA, Trijbels FJ, Blom HJ. The H475Y polymorphism in the glutamate carboxypeptidase II gene increases plasma folate without affecting the risk for neural tube defects in humans. (2003). J Nutr;133(1):75-77.
- Ajit Kumar Saxena i wsp. Evaluation of genetic heterogeneity in glutamate carboxypeptidase II (H475Y) and reduced folate carrier (SLC19A1) gene variants increased risk factor for the development of neural tube defects in eastern region of India. (2012). International Journal of Genetics and Molecular Biology Vol. 4(1), pp. 10-15.
- Galbiatti AL, i wsp. A80G polymorphism of reduced folate carrier 1 (RFC1) gene and head and neck squamous cell carcinoma etiology in Brazilian population. (2011). Mol Biol Rep.;38(2):1071-1078.
- Barlik M. i wsp. Genetycznie uwarunkowane zmiany
- w aktywności reduktazy 5,10-metylenotetra- hydrofolianowej (MTHFR) a występowanie poronień nawracających. (2009) Ginekol Pol;80(10).
- Deka-Pawlik D. Analiza polimorfizmów i ekspresji genów syntazy metioniny (MTR) i reduktazy syntazy metioniny (MTRR) w patogenezie stanu przedrzucawkowego. (2015). Uniwersytet Medyczny im. Karola Marcinkowskiego w Poznaniu Klinika perinatologii i chorób kobiecych. Praca doktorska.
- Laskowska-Klita T., i wsp. Kwas foliowy – rola w metabolizmie komórki. (2012). BROMAT. CHEM. TOKSYKOL. – XLV, , 2, str. 144–151
- Lucyna Kapka-Skrzypczak i wsp. Kwas foliowy – skutki niedoboru i zasadność suplementacji. Medycyna Ogólna i Nauki o Zdrowiu, 2012, Tom 18, Nr 1, 65-69
- Seremak-Mrozikiewicz A., Znaczenie metabolizmu folianów w rozwoju powikłań u kobiet ciężarnych. (2013). Ginekol Pol., 84, 377-384
- Radziejewska A. i wsp. One-Carbon Metabolism and Nonalcoholic Fatty Liver Disease: The Crosstalk between Nutrients, Microbiota, and Genetics. (2020). Lifestyle Genom;13(2):53-63.
- Lietz G, Hesketh J. A network approach to micronutrient genetics: interactions with lipid metabolism. (2009). Current Opinion in Lipidology. Apr;20(2):112-120.
- Czyżewska-Majchrzak Ł. i Paradowska P., Skutki niedoboru i ryzyko suplementacji folianów w diecie. (2010). Nowiny Lekarskie, 79, 6, 457–463
- Hiraoka M. i Kagawa Y., Genetic polymorphisms and folate status. (2017). Congenital Anomalies; 57, 142–149
- Moczulska H. i wsp. Stanowisko ekspertów Polskiego Towarzystwa Genetyki Człowieka i Polskiego Towarzystwa Ginekologów i Położników w sprawie zlecania i interpretacji wyników badań pod kątem wariantów genetycznych w genie MTHFR. (2017). Ginekologia i Perinatologia Praktyczna tom 2, nr 5, strony 234–238
Dietetycy.org.pl » Dietetyka » Jak jeść zdrowo? » Genetyczne uwarunkowania metabolizmu folianów
Licencjonowany dietetyk. Obecnie kontynuuję edukacje na studiach magisterskich na Uniwersytecie Przyrodniczym w Poznaniu. Jestem zwolennikiem zdroworozsądkowego podejścia do żywienia oraz aktywności fizycznej. Moje motto to: „ Świadomość kształtuję twoją rzeczywistość”
 Strefa dla zalogowanych >
Strefa dla zalogowanych >



