Wielopierścieniowe węglowodory aromatyczne (WWA). Czym są i czy należy się ich obawiać?

Wielopierścieniowe węglowodory aromatyczne (WWA) to obszerna grupa związków, które mimo zbliżonej struktury, charakteryzują się zróżnicowaną toksycznością. Powszechnie występują nie tylko w otaczającym nas środowisku, ale również w spożywanej przez nas żywności. W ostatnich latach znaczenie przypisywane WWA wzrosło ze względu na dużą liczbę źródeł transmisji. Długotrwałe narażenie może znacząco odbić się na naszym zdrowiu. Z tego powodu warto bliżej poznać wpływ WWA na zdrowie oraz sposoby na to, jak ograniczyć swoje narażenie.
WWA – charakterystyka
Wielopierścieniowe węglowodory aromatyczne to duża grupa związków organicznych. W jej skład wchodzi kilkaset związków o podobnej strukturze chemicznej. Wszystkie z nich zbudowane są z atomów węgla i wodoru. W ich skład wchodzi dwa lub więcej skondensowanych pierścieni aromatycznych. Te z kolei łączą się ze sobą poprzez 2 atomy węgla. WWA zawierające do sześciu pierścieni aromatycznych są często nazywane „małymi” WWA. WWA zawierające więcej niż sześć pierścieni aromatycznych są nazywane „dużymi” WWA [1,2]. Z reguły WWA występują w postaci bezbarwnych, białych lub jasnożółtych ciał stałych. Powstają w wyniku niecałkowitego spalania materii organicznej [1]. Mogą pochodzić zarówno z naturalnych źródeł spalania, takich jak pożary lasów, jak i powstawać na skutek działalności człowieka [2].
Najprostszym przedstawicielem grupy jest naftalen składający się jedynie z 2 sześcioczłonowych pierścieni. Chociaż istnieje wiele WWA, badania w zakresie zanieczyszczeń żywności i środowiska skupiają się najczęściej w obrębie 14-20. Wynika to z niejednakowej toksyczności poszczególnych WWA. Do najczęściej oznaczanych, szkodliwych dla zdrowia należą [3]:
- Acenaften (C12H10),
- Acenaftylen (C12H8),
- Fluoren (C13H10),
- Antracen (C14H10),
- Fenantren (C14H10),
- Fluoranten (C16H10),
- Piren (C16H10),
- Chryzen (C18H12),
- Benzo(a)antracen (C18H12),
- Benzo(a)piren (C20H12),
- Benzo(b)fluoranten (C20H12),
- Benzo(e)piren (C20H12),
- Benzo(k)fluoranten (C20H12)
- Benzo(j)fluoranten (C20H12)
- Dibenzo(a,h)antracen (C22H14),
- Benzio(g,h,i)perylen (C12H12)
- Indeno(1,2,3-cd)piren (C22H12).
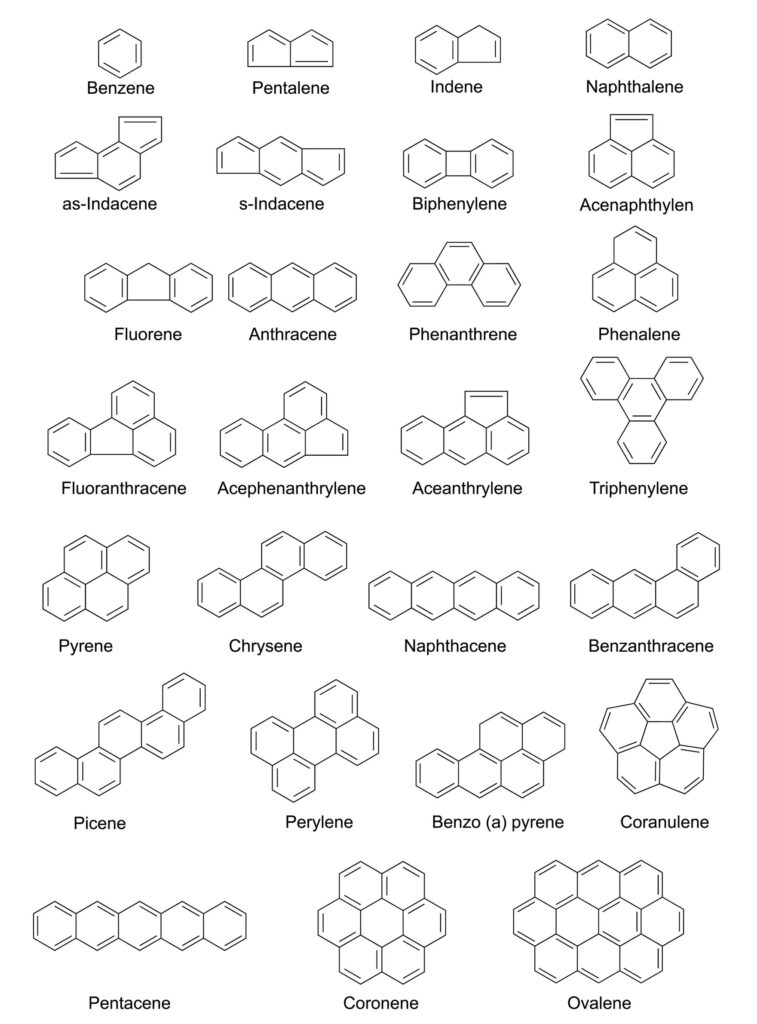
Wymieniając właściwości fizykochemiczne wielopierścieniowych węglowodorów aromatycznych, należy wspomnieć o ich wysokiej temperaturze topnienia i wrzenia. Oprócz tego WWA są wrażliwe na światło. Charakteryzują się niską rozpuszczalnością w wodzie, ale dobrą w rozpuszczalnikach organicznych. Wynika to z ich wysokiej lipofilności. Rozpuszczalność w wodzie zmniejsza się także wraz ze wzrostem masy cząsteczkowej danego WWA. Wraz ze wzrostem masy cząsteczkowej wzrasta natomiast odporność na utlenianie i redukcję [2].
Źródła WWA w środowisku
WWA są wszechobecne w środowisku, gdzie rzadko występują pojedynczo. Znacznie częściej mamy do czynienia z mieszaninami co najmniej dwóch z nich. Obecne w środowisku WWA nie pochodzą z jednego źródła. Źródeł tych jest kilka, z czego największy udział przypisuje się spalaniu paliw kopalnianych, takich jak węgiel ropa naftowa. WWA mogą powstawać także w trakcie produkcji aluminium, koksu, produktów petrochemicznych i gumowych opon. Konserwacja drewna, komercyjne wytwarzanie ciepła i energii elektrycznej oraz spalanie odpadów to kolejne z procesów, które przyczyniają się do uwalniania WWA do atmosfery.
W jednym z badań oceniono emisję WWA z pirolizy zużytych opon. Całkowita emisja WWA z zakładu złomowania opon wynosiła 42,3 g/dzień. Należy pamiętać także o tym, że do emisji WWA znacząco przyczynia się także transport samochodowy [4]. Zbadano, że poziomy niektórych reprezentatywnych WWA obecnych w powietrzu wynoszą 0,02-1,2 ng/m3 na obszarach wiejskich i 0,15-19,3 ng/m3 na obszarach miejskich. Może być to konsekwencją wzmożonego ruchu pojazdów [4].
Poza emisją przemysłową WWA mogą mieć swoje źródło także w rolnictwie. Wypalanie słomy, wrzosowisk czy ścierniska obejmuje spalanie materiałów organicznych w nieoptymalnych warunkach. Przyczynia się to w istotny sposób do emisji WWA do atmosfery [4].
WWA mogą zanieczyszczać powietrze także w konsekwencji palenia papierosów. W przeprowadzonym badaniu wykazano, że wypalenie jednego papierosa wiąże się ze spożyciem od 20 do 40 ng benzo(a)pirenu. Do innych źródeł WWA należą także woda i gleba. Woda między innymi z powodu zanieczyszczeń ściekami przemysłowymi, a woda głównie z powodu opadów atmosferycznych [4].
Zastosowanie
WWA nie są syntetyzowane chemicznie do celów przemysłowych. Istnieje jednak kilka zastosowań komercyjnych WWA. Stosowane są głównie jako półprodukty w przemyśle farmaceutycznym, rolniczym, fotograficznym, w materiałach smarnych i innych gałęziach przemysłu chemicznego. Acenaften jest wykorzystywany w produkcji pigmentów, tworzyw sztucznych i pestycydów. Antracen jest używany jako rozcieńczalnik do konserwacji, a fenantren jest używany do produkcji pestycydów. WWA mogą być zawarte również w asfalcie stosowanym w budownictwie drogowym [4].
Występowanie w żywności
Z uwagi na to, że aż 70% ekspozycji na WWA może pochodzić z diety, warto bliżej przyjrzeć się występowaniu WWA w żywności. Stężenie WWA w poszczególnych grupach produktów spożywczych może być różne. Nie zmienia to jednak faktu, że WWA powszechnie występują w spożywanej przez nas żywności.
Mogą dostawać się do pożywienia na dwa sposoby. Pierwszy z nich wynika z zanieczyszczenia środowiska. WWA znajdziemy w produktach takich jak, orzeszki ziemne, kawa, rafinowany olej rośliny, szpinak, a nawet płatki zbożowe. Niektóre rośliny uprawne, takie jak pszenica, żyto i soczewica, mogą syntetyzować WWA lub pobierać je z wody, powietrza lub gleby [4].
Drugim i zdecydowanie częstszym sposobem zanieczyszczenia żywności jest przetwarzanie żywności [4]. W produktach żywnościowych WWA powstają przede wszystkim podczas smażenia, pieczenia, szczególnie nad otwartym ogniem. Zarówno wędzone, jak i pieczone mięso zawiera więcej WWA niż ich surowe odpowiedniki. WWA tworzą się nie na skutek samego ogrzewania produktu, a na skutek pirolizy tłuszczu, który kapie na ogień z naszego produktu. W zwęglonym mięsie można wykryć nawet do 20 μg WWA w 1 kilogramie [4].
Przeprowadzono badanie, w którym badano związek między rodzajem mięsa, metodą jego obróbki a zawartością WWA w gotowym produkcie. W tym celu pięć próbek mięsa poddano obróbce termicznej. Wśród badanych produktów znalazły się mięso doner kebab wołowe, doner z kurczaka, a także grillowane na węglu drzewnym klopsiki, mięso z kurczaka i ryby. Całkowity poziom zanieczyszczenia WWA wynosił odpowiednio 6,08, 4,42, 4,45, 4,91 i 7,26 μg/kg. W próbkach klopsików i grillowanych ryb wykryto także jeden z najbardziej niebezpiecznych WWA — benzo[a]piren (BaP) [5].
Spośród wszystkich procesów obróbki termicznej, które przyczyniają się do wysokich poziomów zanieczyszczeń WWA, oprócz grillowania, najczęściej wymienia się także wędzenie. Jest to jedna z najstarszych metod obróbki termicznej żywności. Podczas wędzenia produkt jest poddawany działaniu składników dymu i ciepła. Dzięki temu otrzymuje się produkt o charakterystycznych cechach organoleptycznych.
Powstały podczas wędzenia dym składa się nie tylko z pary wodnej, ale zawiera także cząstki stałe, takie jak sadza czy smoła. Składniki fazy stałej często adsorbują WWA, które następnie wchodzą w kontakt z żywnością, powodując jej zanieczyszczenie. Zawartość WWA w dymie wytworzonym w temperaturze powyżej 600°C jest nawet 10-krotnie wyższa niż w dymie wytworzonym poniżej 400°C. Ilość benzo(a)pirenu wzrasta natomiast czterokrotnie przy podniesieniu temperatury z 400 do 900 stopni [6].
Na zawartość WWA w produkcie wpływ ma nie tylko rodzaj obróbki termicznej. Produkty spożywcze, które są bogate w tłuszcz, są bardziej podatne na powstawanie WWA [6]. Zawartość WWA w poszczególnych mięsach może zależeć także od gatunku. Gatunki błękitnych ryb, takich jak tuńczyk, makrela i łosoś wykazują bowiem niższy poziom zanieczyszczenia niż mięczaki [1].
WWA w herbacie?
Herbata jest jednym z najczęściej wybieranych napojów. Ceniona jest nie tylko z uwagi na swój charakterystyczny smak i aromat. Swoją popularność zawdzięcza również swoim właściwościom prozdrowotnym. Herbata nie jest jednak pozbawiona wad. Tak jak wiele innych produktów może zawierać zanieczyszczenia. Gromadzeniu zanieczyszczeń sprzyja między innymi rozwinięta powierzchnia liści. Wśród zanieczyszczeń tych można wyróżnić również wielopierścieniowe węglowodory aromatyczne [7]. Proces produkcji herbaty może dodatkowo wpłynąć na wzrost zawartości WWA w końcowym produkcie. Najwięcej WWA znajdziemy w herbatach poddawanych procesowi prażenia np. w herbacie czarnej [7].
Przeprowadzono badanie, którego celem była ocena zwartości WWA w poszczególnych herbatach i ich naparach. Badano zarówno herbaty liściaste, jak i granulowane i ekspresowe. WWA wykryto we wszystkich analizowanych próbkach. Najwyższy poziom WWA odnotowano dla herbaty czarnej ekspresowej. Jednak biorąc pod uwagę rodzaj herbaty ogółem, to herbaty czarne wykazały najniższy poziom zanieczyszczenia. Najbardziej zanieczyszczone były herbaty białe. Badacze doszli do wniosku, że do naparów herbacianych przenika średnio 12,6% WWA zawartych w suszu [7].
Wymagania prawne
Zawartość WWA w żywności podlega określonym regulacjom prawnym. Najwyższe dopuszczalne poziomy benzo(a)pirenu oraz sumy benzo(a)pirenu, benz(a)antracenu, benzo(b)fluorantenu i chryzenu w produktach spożywczych znajdują się w Rozporządzeniu Komisji (UE) nr 835/2011 z dnia 19 sierpnia 2011 r. Dla przykładu zgodnie z rozporządzeniem maksymalna zawartość benzo(a)pirenu w olejach, tłuszczach i produktach mięsnych wędzonych wynosi 2,0 μg/kg. Pozostałe regulacje prawne zawarte w Rozporządzeniu UE znajdują się w tabeli poniżej [8].
Tabela 1. Najwyższe dopuszczalne poziomy WWA w produktach spożywczych (μg/kg) [8]
Środek spożywczy Benzo(a)piren Suma benzo(a)pirenu, benz(a)antracenu, benzo(b)fluorantenu i chryzenu Oleje i tłuszcze (z wyłączeniem masła kakaowego i oleju kokosowego) 2,0 10,0 Ziarno kakaowe i produkty pochodne 5,0 30,0 Olej kokosowy 2,0 20,0 Mięso wędzone i produkty mięsne wędzone 2,0 12,0 Mięso ryb wędzone i produkty rybołówstwa wędzone. 2,0 12,0 Szproty wędzone i szproty wędzone w konserwie; małże (świeże, schłodzone lub mrożone); mięso i produkty mięsne poddane obróbce cieplnej 5,0 30,0 Małże (wędzone) 6,0 35,0 Przetworzona żywność na bazie zbóż oraz żywność dla niemowląt i małych dzieci 1,0 1,0 Preparaty do początkowego żywienia niemowląt i preparaty do dalszego żywienia niemowląt, w tym początkowe mleko dla niemowląt i mleko następne 1,0 1,0 Produkty dietetyczne specjalnego przeznaczenia medycznego, przeznaczone specjalnie dla niemowląt 1,0 1,0
Drogi narażenia i metabolizm
WWA mogą dostać się do organizmu drogą przewodu pokarmowego, przewodu oddechowego lub w wyniku kontaktu ze skórą. Największą rolę odgrywa jednak przewód pokarmowy. Jest to związane prawdopodobieństwem spożycia zanieczyszczonego pożywienia [9].
WWA są łatwo wchłaniane z przewodu pokarmowego. Skład diety może znacząco wpływać na ilość wchłanianych w przewodzie pokarmowym zanieczyszczeń. Obecność mieszanin oleistych sprzyja wchłanianiu WWA [9].
WWA mają zdolność kumulowania się w tkance tłuszczowej. W mniejszej ilości występują również w wątrobie, nerkach, jajnikach i śledzionie [10]. W organizmie WWA ulegają przemianom pod wpływem mikrosomalnego układu enzymatycznego. Pod wpływem działania enzymów, takich jak cytochrom P450, czy hydrolaza epoksydowa dochodzi do powstania reaktywnych metabolitów. Cytochrom przekształca WWA w optycznie czynne tlenki (epoksydy). Epoksydy wykazują dużą reaktywność w stosunku do DNA. Hydrolaza epoksydowa przekształca z kolei tlenki w dihydrodiole (diole). WWA mogą być również metabolizowane do szeregu chinonów. Metabolity te mogą łączyć się z DNA, białkami i lipidami, powodując ich uszkodzenie [9,10].
Benzo[a]piren i inne WWA mogą łatwo przechodzić barierę łożyskową. Przeprowadzane badania wykazały, że są również wykrywalne w mleku matki [9].
Główną drogą wydalania WWA i ich metabolitów są mocz i kał. Metabolity sprzęgane są z glukuronianem i siarczanem, i w postaci rozpuszczalnych związków wydalane są z moczem. W przypadku WWA o dużej masie cząsteczkowej największą rolę odgrywa wydalanie wraz z kałem [9,10].
Wpływ na zdrowie
Genotoksyczność
Genotoksyczność oznacza zdolność do reagowania z DNA. Odgrywa ona istotną rolę w procesie nowotworowym. Działanie genotoksyczne WWA zostało wykazane zarówno w badaniach na zwierzętach, jak i badaniach na komórkach ssaków, w tym ludzi. Reakcja WWA z DNA prowadzi do powstawania wielu mutacji.
W badaniach na modelach zwierzęcych wykazano, że WWA mogą być przyczyną mutacji w obrębie genu p53. Gen ten odpowiada za kontrole przebiegu cyklu komórkowego. Mutacja spowodowana ekspozycją na WWA powoduje jego unieczynnienie. Gdy gen p53 zostaje uszkodzony, organizm przestaje być zdolny do eliminacji komórek z uszkodzonym DNA. Mutacja zaś zostaje utrwalona w wyniku podziałów komórkowych. W genie p53 dochodzi między innymi do zamiany zasad azotowych (guanina → tymina). Zamiana ta została wykryta między innymi w komórkach guzów nowotworowych płuc u palaczy [10].
Rakotwórczość
Największy wpływ na zdrowie wywierają metabolity WWA. Epoksydy i dihydrodiole wiążą się z białkami i DNA. W wyniku tych interakcji dochodzi do uszkodzeń, które mogą powodować mutacje, wady rozwojowe, a nawet przyczynić się do rozwoju nowotworu. W przeciętnej amerykańskiej diecie spożycie rakotwórczych WWA oszacowano na 1–5 μg/dzień. Największym źródłem tych związków okazały się przetworzone zboża i gotowane mięso.
Szereg badań na modelach zwierzęcych potwierdza rakotwórcze właściwości WWA. W jednym z badań wykazano, że u zwierząt narażonych na wysokie poziomy WWA rozwinął się rak płuc (w wyniku wdychania WWA), rak żołądka (w wyniku spożycia WWA) oraz rak skóry (w wyniku kontaktu WWA ze skórą) [4].
Badania potwierdzają również związek WWA z rozwojem raka piersi. Gammon i wsp. wykazali, że u kobiet, które posiadają we krwi wysoki poziom kompleksów WWA-DNA, występuje większe prawdopodobieństwo rozwoju raka piersi. Prawdopodobieństwo może wzrosnąć nawet o 50%. Inne badanie wykazało, że istnieje związek między ekspozycją na WWA a rakiem piersi u kobiet z nadwagą lub otyłością po menopauzie. Zwiększone ryzyko zachorowania zostało potwierdzone także u kobiet z prawidłową masą ciała przed menopauzą [11].
W badaniach narażenia zawodowego wykazano natomiast istotny związek między ekspozycją na WWA a rakiem płuc. Wysoki poziom WWA u osób niepalących był związany ze zwiększonym ryzykiem raka płuc w porównaniu z osobami, u których WWA były niewykrywalne [9]. Badając wpływ WWA na rozwój nowotworów, stwierdzono, że nie ma wystarczających dowodów wskazujących na związek WWA z rozwojem raka pęcherza moczowego [9].

Teratogenność
WWA wykazały w badaniach także zdolność do powodowania wad rozwojowych płodu. Badania laboratoryjne na myszach wykazały, że wysokie narażenie na WWA (benzo(a)antracen, benzo(a)piren i naftalen w czasie ciąży powoduje wady wrodzone płodu [2].
Ekspozycja na WWA podczas ciąży jest związana z niekorzystnym wpływem na rozwijający się płód. Konsekwencją narażenia może być niska masa urodzeniowa, wady rozwojowe serca, a także niższy iloraz inteligencji dziecka. Oprócz tego pojawić się mogą problemy behawioralne [2].
Rozrodczość
Narażenie na kontakt z WWA wpływa niekorzystnie na rozrodczość. Nadmierna ekspozycja u mężczyzn może prowadzić do zaburzeń podziałów komórkowych w obrębie organów rozrodczych. W konsekwencji dochodzi do spadku jakości produkowanego nasienia, a także do zmniejszenia zdolności do zapłodnienia komórki jajowej [10].
Co możemy zrobić, aby ograniczyć narażenie na WWA?
WWA są wszechobecne zarówno w otaczającym nas środowisku, jak i w żywności przez nas spożywanej. Trudno zatem całkowicie wyeliminować ekspozycję na WWA. Możemy jednak podjąć parę kroków, aby zminimalizować ryzyko związane z nadmiernym kontaktem z WWA.
- Jednym ze źródeł narażenia na WWA jest dym tytoniowy. Zawartość rakotwórczego benzo(a)pirenu w dymie wynosi od 20 do 25 ng/g. To około 5 razy więcej niż w herbacie [12]. Dlatego osoby, które są palaczami, mogą ograniczyć narażenie, zarówno swoje, jak i osób ze swojego otoczenia, poprzez rzucenie palenia.
- Kolejnym sposobem jest zmniejszenie spożycia żywności wędzonej i grillowanej. Nie musimy rezygnować z niej całkowicie. Przygotowując posiłki na grillu, warto zaopatrzyć się w specjalne tacki, które ograniczą kontakt żywności z ogniem. Ponadto możesz zamienić tradycyjny grill na grill elektryczny. Przydatny może okazać się także piekarnik. Mięso pieczone w piekarniku elektrycznym posiada bowiem niższy poziom WWA niż mięso pieczone na węglu.
- Warto zwrócić uwagę na marynaty do mięs. Niektóre składniki marynat mogą bowiem wpływać na tworzenie WWA podczas obróbki termicznej. Wykazano, że składniki o właściwościach przeciwutleniających, takie jak czosnek i cebula hamowały powstawanie WWA w smażonej wieprzowinie [13].
- Wykazano także, że mycie wędzonych ryb wpływa na zmniejszenie poziomu WWA w porównaniu do tych niemytych. Zatem dokładne umycie wędzonych ryb przed gotowaniem może przekładać się na bezpieczeństwo ich spożycia [13].
- Ekspozycję na WWA można ograniczyć także poprzez wyeliminowanie kosmetyków na bazie smoły węglowej [14].
- Należy również unikać kontaktu WWA ze skórą w miejscu pracy poprzez noszenie odzieży ochronnej. Narażenie w miejscu pracy ograniczyć może także specjalna maseczka ochronna [14].
Podsumowanie
Nie ulega wątpliwości, że WWA negatywnie wpływają na zdrowie. Okazuje się, że na zdrowie w największym stopniu wpływają nie same WWA, a ich metabolity powstające w organizmie. W wielu przeprowadzonych badaniach wykazano ich działanie rakotwórcze. Oprócz tego mają właściwości genotoksyczne i teratotoksyczne. Na kontakt z wielopierścieniowymi węglowodorami aromatycznymi jesteśmy narażeni nie tylko w miejscu pracy. Spożywana przez nas żywność zawierać znaczne ilości zanieczyszczeń. Jesteśmy jednak w stanie ograniczyć ekspozycję na WWA, dzięki świadomym wyborom żywieniowym. Pozwoli to zmniejszyć ryzyko rozwoju wielu chorób, w tym chorób nowotworowych w przyszłości.
Bibliografia:
- Purcaro, G., Moret, S., & Conte, L. S. (2013). Overview on polycyclic aromatic hydrocarbons: occurrence, legislation and innovative determination in foods. Talanta, 105, 292-305.
- Abdel-Shafy, H. I., & Mansour, M. S. (2016). A review on polycyclic aromatic hydrocarbons: source, environmental impact, effect on human health and remediation. Egyptian journal of petroleum, 25(1), 107-123.
- Kubiak, M. S. (2013). Wielopierścieniowe węglowodory aromatyczne (WWA)–ich występowanie w środowisku i w żywności. Problemy Higieny i Epidemiologii, 94(1), 31-36.
- Rengarajan, T., Rajendran, P., Nandakumar, N., Lokeshkumar, B., Rajendran, P., & Nishigaki, I. (2015). Exposure to polycyclic aromatic hydrocarbons with special focus on cancer. Asian Pacific Journal of Tropical Biomedicine, 5(3), 182-189.
- Sahin, S., Ulusoy, H. I., Alemdar, S., Erdogan, S., & Agaoglu, S. (2020). The presence of polycyclic aromatic hydrocarbons (PAHs) in grilled beef, chicken and fish by considering dietary exposure and risk assessment. Food Science of Animal Resources, 40(5), 675.
- Singh, L., Varshney, J. G., & Agarwal, T. (2016). Polycyclic aromatic hydrocarbons’ formation and occurrence in processed food. Food Chemistry, 199, 768-781.
- Ciemniak A, Mocek K. Wielopierścieniowe weglowodory aromatyczne w herbatach i ich naparach [Polycyclic aromatic hydrocarbons in tea and tea infusions]. Rocz Panstw Zakl Hig. 2010;61(3):243-8. Polish. PMID: 21365858.
- Rozporządzenie Komisji (UE) nr 835/2011 z dnia 19 sierpnia 2011 r. zmieniające rozporządzenie (WE) nr 1881/2006 odnośnie do najwyższych dopuszczalnych poziomów wielopierścieniowych węglowodorów aromatycznych w środkach spożywczych
- Choi, H., Harrison, R., Komulainen, H., & Saborit, J. M. D. (2010). Polycyclic aromatic hydrocarbons. In WHO guidelines for indoor air quality: selected pollutants. World Health Organization.
- Zasadowski, A., & Wysocki, A. (2002). Niektore aspekty toksycznego dzialania wielopierscieniowych weglowodorow aromatycznych [WWA]. Roczniki Państwowego Zakładu Higieny, 1(53), 33-45.
- Zamora-León, P., & Delgado-López, F. (2020). Polycyclic Aromatic Hydrocarbons and their Association with Breast Cancer.
- Praca zbiorowa pod redakcją Z.E Sikorskiego i H.Staroszczyk, 2017. Chemia żywności. Biologiczne właściwości składników żywności (Tom 2). Wydawnictwo Naukowe PWN
- Sampaio, G. R., Guizellini, G. M., da Silva, S. A., de Almeida, A. P., Pinaffi-Langley, A. C. C., Rogero, M. M., … & Torres, E. A. (2021). Polycyclic Aromatic Hydrocarbons in Foods: Biological Effects, Legislation, Occurrence, Analytical Methods, and Strategies to Reduce Their Formation. International Journal of Molecular Sciences, 22(11), 6010.
- http://www.idph.state.il.us/cancer/factsheets/polycyclicaromatichydrocarbons.htm
Dietetycy.org.pl » Dietetyka » Jak jeść zdrowo? » Wielopierścieniowe węglowodory aromatyczne (WWA). Czym są i czy należy się ich obawiać?
Jestem absolwentką dietetyki na Uniwersytecie Przyrodniczym w Poznaniu. Zdobytą wiedzę żywieniową pogłębiam aktualnie na studiach magisterskich na tym samym kierunku. Głównym obszarem moich zainteresowań są choroby dietozależne, powstające na tle wadliwego żywienia. Na co dzień stawiam na zdroworozsądkowe podejście do diety.
 Strefa dla zalogowanych >
Strefa dla zalogowanych >