Toczeń rumieniowaty jest chorobą autoimmunologiczną, w której układ odpornościowy atakuje własne tkanki. Najczęstszym typem tocznia jest toczeń rumieniowaty układowy (SLE, ang. Systemic Lupus Erythematosus). Na skutek nieprawidłowej reakcji immunologicznej dochodzi do rozległego zapalenia i uszkodzenia zaatakowanych narządów. SLE może dotyczyć praktycznie każdej części ciała – skóry, mózgu, płuc, nerek czy naczyń krwionośnych. Obecnie nie ma lekarstwa, które pozwoli na wyleczenie tocznia. Jednak odpowiednie interwencje medyczne i modyfikacje stylu życia (w tym diety) mogą być pomocne w kontrolowaniu przebiegu tej choroby [1].
Spis treści:
- Epidemiologia
- Przyczyny
- Objawy
- Czy dieta ma znaczenie przy toczniu?
- Dieta – zasady i wyniki badań
- Podsumowanie
- Bibliografia
Epidemiologia choroby
Toczeń rumieniowaty to choroba, która może dotknąć każdego, jednak najczęściej dotyczy kobiet. W grupie wiekowej 15-44 lat stosunek kobiet do mężczyzn wynosi aż 13:1. Kobiety stanowią zatem 90% wszystkich chorych na toczeń rumieniowaty układowy. Natomiast u dzieci i osób starszych, stosunek ten wynosi jedynie 2:1. SLE występuje we wszystkich grupach etnicznych, ale najczęściej dotyka osób niebędących rasy białej [2]. Jest to schorzenie stosunkowo rzadkie. Szacuje się, że w Europie i USA na 100 000 osób przypada od 2 do 12 zachorowań rocznie [4].
Jakie czynniki mają udział w rozwoju SLE?
W ostatnich latach doszło do znacznych postępów w rozumieniu SLE. Dokładny tryb początku i rozwoju choroby pozostaje jednak nieuchwytny. Obecnie wskazuje się na złożoną interakcję eksposom-genom, która prowadzi do zmian ekspresji genów. Hipoteza ta opiera się na tym, że czynniki środowiskowe oddziałują na nasz materiał genetyczny. Prowadzą do zmian metylacji DNA i powstania choroby u osób z predyspozycją genetyczną.
Do czynników środowiskowych, które mogą się przyczyniać do rozwoju SLE zalicza się:
- promieniowanie ultrafioletowe, zarówno UVA, jak i UVB;
- zanieczyszczenie powietrza pyłami;
- pierwiastki śladowe, takie jak: selen, cynk, miedz, kadm, nikiel, złoto, rtęć, ołów, uran i krzemionka;
- estrogeny i hormonalne terapie zastępcze;
- bisfenol A;
- ftalany (sole i estry kwasu ftalowego);
- wielopierścieniowe węglowodory aromatyczne;
- alkohol;
- infekcje (wirus Epsteina-Barra).
Na podstawie wielu badań stwierdzono, że zmiany epigenetyczne wtórne do narażenia na powyższe czynniki środowiskowe, są istotnym elementem etiopatogenezy SLE. Wpływają one także, na wiek rozpoczęcia choroby i jej przebieg [3]. Warto również zwrócić uwagę, na wspomnianą już zależność pomiędzy występowaniem SLE a płcią i pochodzeniem etnicznym.
Przeprowadzone zostały badania, które porównywały częstość występowania choroby u mieszkańców Afryki Zachodniej i Afroamerykanów. Mimo że łączy ich to samo pochodzenie etniczne, to druga grupa badanych wykazywała większą zachorowalność. Jak to tłumaczyć? Prawdopodobnie przyczynia się do tego stosowanie antybiotyków i wyższy stopień higieny. To prowadzi do usunięcia niektórych gatunków drobnoustrojów. Zależność ta podkreśla, jak istotne jest ochronne działanie naszego mikrobiomu [7].
Objawy i przebieg SLE
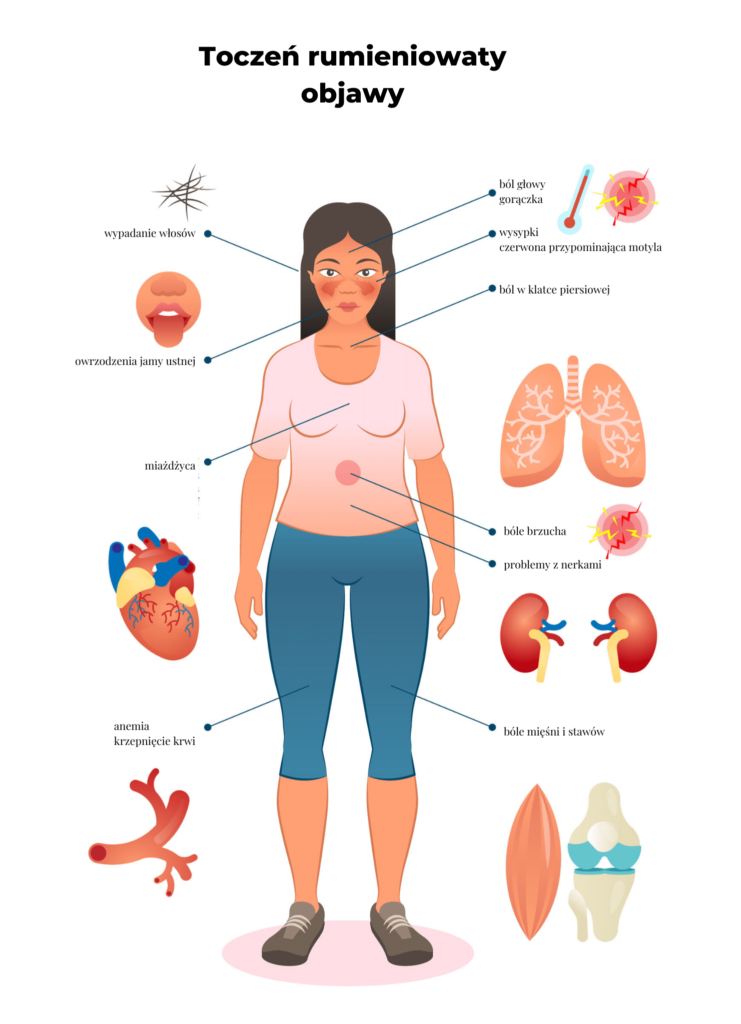
Toczeń może wpływać na prawie każdą część ciała, a objawy różnią się w zależności od osoby. Charakterystyczne są okresy remisji i zaostrzeń choroby – objawy ulegają zmniejszeniu, a następnie pogorszeniu. Nie istnieje jednorodny obraz kliniczny, ale do zmian spowodowanych tym schorzeniem można zaliczyć:
- bóle mięśni i stawów – często w obszarze szyi, ud, ramion;
- gorączkę – spowodowaną stanem zapalnym lub infekcją;
- wysypki – charakterystycznym objawem jest czerwona wysypka na twarzy, przypominająca kształtem motyla;
- ból w klatce piersiowej;
- wypadanie włosów – występują plamy, łysiny;
- wrażliwość na słońce lub światło – nadmierna ekspozycja może powodować wysypki, gorączkę, zmęczenie lub ból stawów;
- problemy z nerkami – dotyczą aż połowy osób z toczniem;
- owrzodzenia jamy ustnej;
- anemię;
- problemy z pamięcią;
- krzepnięcie krwi;
- choroby oczu – takie jak zapalenie oka, suchość oczu i wysypka na powiekach [5].

Czy dieta ma znaczenie przy toczniu rumieniowatym?
Terapia żywieniowa jest niezwykle ważnym czynnikiem przy SLE. Jest istotna zarówno jako element profilaktyki, jak i działanie zmniejszające objawy chorób współistniejących.
🔎 Przegląd badań nad interwencjami stylu życia w leczeniu tocznia rumieniowatego układowego [11] wykazał, że ćwiczenia fizyczne oraz wsparcie psychologiczne pomagają łagodzić objawy depresji, zmęczenia i poprawiają funkcje fizyczne. Ponadto, dieta śródziemnomorska może wspierać redukcję ryzyka sercowo-naczyniowego, choć brakuje dużych badań interwencyjnych. Istotne jest także stosowanie fotoprotekcji, szczególnie ochrony przed słońcem. Interwencje te zdaniem naukowców powinny być traktowane jako uzupełnienie terapii farmakologicznej, a nie jej zastąpienie.
Pacjenci z toczniem rumieniowatym układowym są bardziej narażeni na choroby sercowo-naczyniowe i anemię. Zmagają się z niską gęstością mineralną kości i wysokim poziomem homocysteiny we krwi. Ponad połowa chorych wykazuje objawy, takie jak otyłość, nadciśnienie i dyslipidemię. To zwiększa ryzyko powstania cukrzycy czy miażdżycy. Dlatego też modyfikacje diety i stosowanie odpowiedniej suplementacji jest tak istotne. Stan odżywienia może wpływać na przebieg i rokowanie SLE.
Dieta osób z SLE powinna być bogata w witaminy i składniki mineralne oraz jedno- i wielonienasycone kwasy tłuszczowe. Zaleca się, aby podaż energii była umiarkowana. Najnowsze doniesienia sugerują, że model diety śródziemnomorskiej korzystnie wpływa na pacjentów z toczniem. Przyczynia się do ochrony organizmu przed stanami zapalnymi, stresem oksydacyjnym i wspiera układ odpornościowy [6].
Warto wspomnieć, że wyjątkowa rola żywności nie wynika jedynie z jej wartości odżywczych. To też efekt modulacji mikrobioty jelitowej, która również ma wpływ na toczeń rumieniowaty [7].

Jak dostosować dietę do tocznia rumieniowatego?
Zmiany dotyczące żywienia przy toczniu rumieniowatym można podzielić na kilka kategorii.
Ograniczenie kalorii
Udowodnione zostało, że ograniczenie podaży energii powoduje różne korzyści dla układu immunologicznego. Dzieje się tak, ponieważ ujemny bilans energetyczny prowadzi do zmian w mikrobiocie jelitowej. Jak już wiadomo, otyłość jest częstym problemem przy SLE, szczególnie wśród osób leczonych przewlekle kortykosteroidami. Może dotyczyć nawet 40-50% pacjentów i wiąże się z większą męczliwością. Istnieją dowody, które wskazują, że podaż energii u otyłych pacjentów przy toczniu na poziomie 1000-1200 kcal/dobę u kobiet i 1200-1400 kcal/dobę u mężczyzn przynosiła pozytywny efekt. Są to wartości bardzo niskie, dlatego też bardzo korzystne byłoby skorzystanie z indywidualnego doradztwa żywieniowego [7].
Wielonienasycone kwasy tłuszczowe
Spośród czynników ryzyka miażdżycy w SLE decydujący wpływ na odlegle rokowanie pacjentów ma dyslipidemia. Prowadzi do zwiększenia prawdopodobieństwa wystąpienia incydentów sercowo-naczyniowych. Wpływa też na objawy, takie jak toczniowe zapalenie nerek i uszkodzenie mózgu. Dlatego też dyslipidemia w przebiegu SLE powinna być niezwłocznie leczona, aby ograniczyć występujące objawy ogólne i śmiertelność.
Jednym ze sposobów kontrolowania zaburzeń gospodarki lipidowej jest zdrowa dieta. Zdrowa, czyli bogata w nienasycone kwasy tłuszczowe z rodziny omega 3 – kwas eikozapentaenowy (EPA) i dokozaheksaenowy (DHA) [6].
Kwasy omega 3 wykazują działanie przeciwzapalne – hamują produkcję cytokin zapalnych i zmniejszają stan zapalny. Chronią przed wolnymi rodnikami, co pomaga w prewencji chorób sercowo-naczyniowych. Wpływają także na regulację poziomu cholesterolu całkowitego, cholesterolu LDL i triglicerydów. Inne wielonienasycone kwasy tłuszczowe, zwłaszcza kwas α-linolenowy i γ-linolenowy, również wykazują pozytywne działanie. Powinny być obecne w diecie pacjentów z toczniem.
Co ciekawe, suplementacja kwasami omega 6 wykazuje działanie niekorzystne i może nasilać aktywność SLE [7].
Białka i aminokwasy
Ze względu na to, że ponad połowa pacjentów z SLE zmaga się z chorobami nerek, bardzo ważne jest, aby przyjmować odpowiednią ilość białka. Ograniczenie jego spożycia wpływa korzystnie na kontrolowanie postępu chorób nerek [6]. Zaleca się podaż 0,6 g białka/kg masy ciała/dzień. Taka ilość poprawia stan odżywienia i współczynnik filtracji kłębuszkowej. Nadmierne spożycie powoduje utratę minerałów kostnych, szczególnie u osób z młodzieńczym toczniem [7].
Pozytywny wpływ na objawy SLE obserwuje się przy suplementacji tauryną. Jest to główny wolny wewnątrzkomórkowy β-aminokwas w większości tkanek. Z diety pozyskujemy go przede wszystkim z jaj, mięsa i owoców morza. W organizmie wykazuje działanie przeciwutleniające, przeciwzapalne i przeciwapoptyczne. Suplementacja tauryną, u osób z SLE, powoduje złagodzenie zaburzeń pracy serca i zmniejsza apoptozę.
Aminokwasy, których powinno się unikać przy SLE to L-arginina, fenyloalanina i tyrozyna. Ograniczenie w diecie dwóch ostatnich przyczynia się do zmniejszenia wytwarzania autoprzeciwciał. Nadmierne spożycie L-argininy zwiększa nasilenie zwłóknienia nerek i prawdopodobieństwo śmierci u myszy [7].
Błonnik pokarmowy
Odpowiednia podaż błonnika pokarmowego jest zalecana ze względu na jego wielokierunkowe działanie na organizm. Błonnik bierze udział w zmniejszaniu stanu zapalnego, ryzyka chorób sercowo-naczyniowych. Promuje ruchomość jelit [6]. Jaka ilość jest odpowiednia? Szacuje się, że dzienne spożycie powinno wynosić 25 g dla kobiet i 38 g dla mężczyzn. Należy pamiętać jednak o odpowiedniej podaży wody. Warto unikać nadmiernych ilości błonnika. Mogą one prowadzić do zmniejszonej absorpcji witamin i składników mineralnych [7].
Witaminy
Badania nad wpływem witamin na przebieg tocznia rumieniowatego koncentrują się głównie na witaminie A, D i E.
Witamina D
Związek pomiędzy witaminą D a SLE został opisany już w 1995 roku. Wiele badań wykazało, że jej niedobór występuje u znacznej ilości pacjentów z toczniem rumieniowatym układowym.
Może to być związane z nadwrażliwością osób z SLE na promieniowanie słoneczne, które jak wiadomo jest dla nas głównym źródłem witaminy D [8]. Witamina D odgrywa kluczową rolę w homeostazie wapnia. Dlatego też u chorych na toczeń obserwuje się spadek gęstości mineralnej kości.
Odpowiednia podaż witaminy D osłabia postęp choroby, wpływa na zwiększenie liczby regulatorów limfocytów T i regulację apoptozy. Co więcej, może również zmniejszać ryzyko chorób sercowo-naczyniowych.
Jaka dawka jest zalecana? Niestety nie ma na to jednej odpowiedzi, ponieważ określenie dokładnych dawek nie jest jeszcze możliwe. Konieczne jest podejście indywidualne. Niemniej, zgodnie z międzynarodowymi zaleceniami, suplementacja w dawce 800-1000 IU/dzień lub 50000 IU/miesiąc jest bezpieczna dla większości osób [6].
Witamina A
Witamina A jest niezbędna do prawidłowego funkcjonowania organizmu, a w tym utrzymania integralności układu odpornościowego. Jej fizjologiczna forma, kwas całkowicie trans-retinowy (ATRA), wykazuje działanie zmniejszające stan zapalny w SLE.
Co więcej, sama lub w połączeniu z niskimi dawkami leków immunosupresyjnych, korzystnie oddziałuje na nerki. Badania na myszach z toczniem wskazują, że suplementacja witaminą A prowadziła do hamowania zmian skórnych i zmniejszenia jej grubości [6].
Witamina E
Witamina E jest silnym „wymiataczem” wolnych rodników i nadtlenków. Odpowiednia jej podaż z dietą prowadzi do zmniejszenia stresu oksydacyjnego. Co więcej, jest niezbędnym składnikiem dla utrzymania prawidłowego funkcjonowania układu odpornościowego. Jednak w przypadku witaminy E, jej działanie na SLE jest nieco bardziej skomplikowane.
Niektóre badania, wskazują na większą przeżywalność myszy chorych na toczeń, przy podawaniu niskich dawek witaminy E. Natomiast wysoka suplementacja miała odwrotny skutek. To sugeruje, że witamina E może nie być korzystna w przypadku chorób autoimmunologicznych [6].
Witamina B6
Pacjenci z SLE często zmagają się z miażdżycą. Co za tym idzie, mają podwyższony poziom homocysteiny (HCY) w surowicy. Wykazano, że witamina B6 obniża poziom HCY i działa jako koenzym w metabolizmie przeciwciał i cytokin.
Suplementacja witaminą B6 może prowadzić do tłumienia aktywnego stanu zapalnego i zapobiegania występowaniu zaostrzeń tocznia rumieniowatego. Nie obserwuje się natomiast związku pomiędzy obniżeniem zmian miażdżycowych a suplementacją witaminą B6 [6].
Witamina C
Witamina C jest znana ze swoich właściwości antyoksydacyjnych. U pacjentów z SLE bierze udział w odpowiedzi na stres oksydacyjny. Wpływa korzystnie na redukcję stanów zapalnych.
Odpowiednie spożycie witaminy C może zapobiegać występowaniu okresów zaostrzeń choroby [6]. W diecie osób z SLE należy uzupełniać witaminę C w maksymalnej ilości 1 g/dobę lub, ze względu na synergistyczne działanie, w skojarzeniu z witaminą E [7].
Składniki mineralne
Należy zwrócić szczególną uwagę na ograniczenie spożycia składników mineralnych. Szczególnie dotyczy to składników takich jak cynk (Zn) i sód (Na). Zmniejszenie zawartości cynku w diecie może poprawić objawy u pacjentów z SLE [7].
Co więcej, umiarkowana podaż na poziomie 5,0 ppm/dzień prowadzi do obniżenia początku niedokrwistości hemolitycznej i rozwoju chorób nerek. Uważa się, że nadmierna ilość sodu może być potencjalnym czynnikiem ryzyka chorób autoimmunologicznych [6]. Zaleca się, aby pacjenci z toczniem rumieniowatym nie przekraczali 3 g/dzień [7].
Pozytywny wpływ na SLE ma natomiast selen (Se). W badaniach na myszach zwiększał ich przeżywalność i aktywność komórek NK (natural killers) [6]. Selen ma działanie przeciwutleniające i przeciwzapalne [7].
Kolejnym składnikiem istotnym w przebiegu tocznia jest wapń (Ca). Szczególnie ważny jest u pacjentów z obniżoną gęstością mineralną kości. W przypadku trudności, w pozyskaniu wapnia z dietą, wskazana jest suplementacja w dawce >1500 mg/dzień [9].
Ze względu na to, że anemia dotyczy nawet 70% pacjentów z SLE, należy zwrócić uwagę na odpowiednią podaż żelaza (Fe). Podobnie jak w przypadku wapnia, suplementacja powinna być wdrożona, jeśli dieta nie pokrywa dziennego zapotrzebowania [9].
Rola antyoksydantów
Polifenole to bioaktywne składniki, zawarte w szerokiej gamie produktów spożywczych. W szczególności zawierają je owoce i warzywa, czerwone wino czy herbata. Wykazują działanie przeciwutleniające i przeciwdrobnoustrojowe, promują odpowiedź immunologiczną [7].
Termin polifenole obejmuje wiele substancji, między innymi: kwasy fenolowe, flawonoidy, diaryloheptanoidy i aryloalkanony, lignany i stilbeny. Potencjalne korzystne działanie polifenoli w przebiegu SLE jest związane z ich zdolnością do ochrony przed stresem oksydacyjnym. Co więcej, związki te biorą udział w modulowaniu enzymów związanych ze stanem zapalnym [6].
Kurkuma a toczeń
Ze względu na przewlekły stan zapalny w organizmie pacjentów z SLE poszukuje się związków przeciwutleniających, które tłumią aktywność cytokin zapalnych i chronią przed wolnymi rodnikami. Taką substancją może być zawarta w kurkumie kurkumina. W badaniach na ludziach wykazuje działanie zmniejszające poziomy reaktywnych form tlenu. Z tego względu warto dołączyć tę przyprawę do diety osób z toczniem rumieniowatym [10].
Podsumowanie
Toczeń rumieniowaty to choroba, która charakteryzuje się okresami zaostrzeń i remisji. Całkowite wyleczenie nie jest możliwe. Obserwuje się coraz więcej dowodów wskazujących wpływ pewnych składników żywieniowych na profilaktykę i łagodzenie objawów SLE. Jest to zagadnienie niezwykle obiecujące i wymagane są dalsze badania w tym zakresie. Na szczególną uwagę zasługuje model diety śródziemnomorskiej, której założenia pokrywają się z wyżej wymienionymi modyfikacjami żywieniowymi.
Bibliografia:
- Systemic Lupus Erythematosus (SLE). (2018). Pobrano 16 Czerwca 2022, z https://www.cdc.gov/lupus/facts/detailed.html
- Fava, A., & Petri, M. (2019). Systemic lupus erythematosus: diagnosis and clinical management. Journal of autoimmunity, 96, 1-13.
- Gulati, G., & Brunner, H. I. (2018, April). Environmental triggers in systemic lupus erythematosus. In Seminars in arthritis and rheumatism (Vol. 47, No. 5, pp. 710-717). WB Saunders.
- Samotij, D. (2018). Leczenie tocznia rumieniowatego układowego—wyzwania i perspektywy na przyszłość. In Forum Dermatologicum (Vol. 4, No. 2, pp. 70-77).
- Al-Gahtani, S. N. (2021). A review of systemic lupus erythematosus (SLE): symptoms, risk factors, treatment, and health related quality of life issues. Open Journal of Rheumatology and Autoimmune Diseases, 11(4), 115-143.
- Aparicio-Soto, M., Sánchez-Hidalgo, M., & Alarcón-de-la-Lastra, C. (2017). An update on diet and nutritional factors in systemic lupus erythematosus management. Nutrition Research Reviews, 30(1), 118-137.
- Constantin, M. M., Nita, I. E., Olteanu, R., Constantin, T., Bucur, S., Matei, C., & Raducan, A. (2019). Significance and impact of dietary factors on systemic lupus erythematosus pathogenesis. Experimental and therapeutic medicine, 17(2), 1085-1090.
- Sakthiswary, R., & Raymond, A. A. (2013). The clinical significance of vitamin D in systemic lupus erythematosus: a systematic review. PloS one, 8(1), e55275.
- Klack, K., Bonfa, E., & Borba Neto, E. F. (2012). Diet and nutritional aspects in systemic lupus erythematosus. Revista brasileira de reumatologia, 52, 395-408.
- de Medeiros, M. C. S., Medeiros, J. C. A., de Medeiros, H. J., Leitão, J. C. G. D. C., & Knackfuss, M. I. (2019). Dietary intervention and health in patients with systemic lupus erythematosus: a systematic review of the evidence. Critical reviews in food science and nutrition, 59(16), 2666-2673.
- Tsoi A, Gomez A, Boström C, Pezzella D, Chow JW, Girard-Guyonvarc’h C, Stamm T, Arnaud L, Parodis I. Efficacy of lifestyle interventions in the management of systemic lupus erythematosus: a systematic review of the literature. Rheumatol Int. 2024 May;44(5):765-778. doi: 10.1007/s00296-024-05548-x. Epub 2024 Mar 7. PMID: 38451302; PMCID: PMC10980639.
- Data pierwotnej publikacji: 27.06.2022
- Data ostatniej aktualizacji o wyniki badań: 8.10.2024







