Suplementy w PCOS. O te składniki warto zadbać

W artykule znajdziesz przegląd wybranych suplementów i składników diety pomocnych w terapii PCOS, czyli zespołu policystycznych jajników.
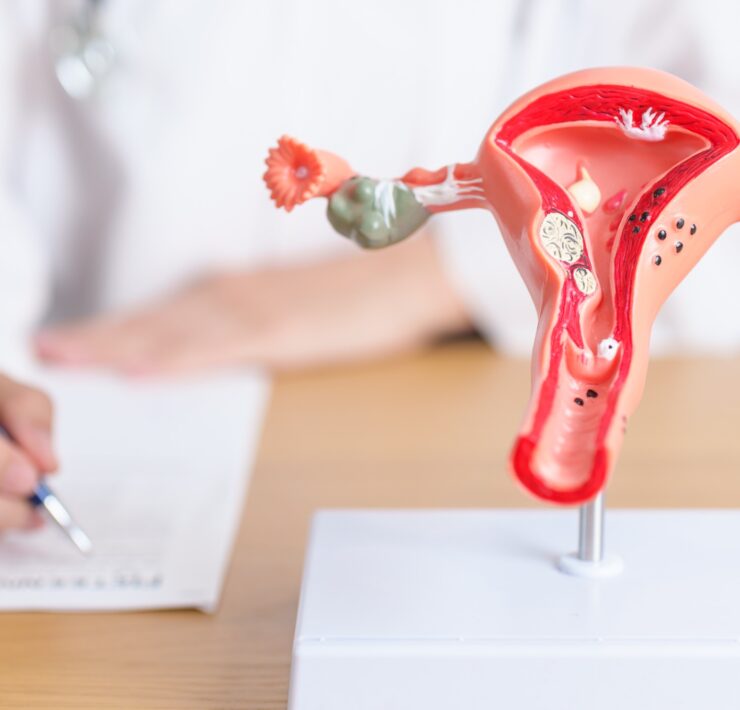
Czym jest PCOS?
Zespół policystycznych jajników (PCOS) nazywany jest także zespołem wielotorbielatowych jajników. Dotyka on kobiet w wieku rozrodczym i charakteryzuje się specyficznym obrazem jajników w badaniu USG. Ponadto występowaniem bezowulacyjnych cykli i nadmiernym wytwarzaniem androgenów, czyli męskich hormonów płciowych. Ze względu na zaburzenia owulacji PCOS stanowi jedną z najczęstszych przyczyn niepłodności u kobiet. Co więcej, stanem współwystępującym z zespołem policystycznych jajników jest insulinooporność, zwiększająca ryzyko rozwoju cukrzycy II typu.
Według różnych szacunków PCOS dotyczy od 5% do nawet 10% populacji kobiet w wieku rozrodczym. [1]
Jak się objawia PCOS?
Zespół policystycznych jajników cechuje szereg objawów. Kliniczna manifestacja PCOS obejmuje głównie zaburzenia miesiączkowania, w tym nieregularne miesiączki lub występujące rzadko czy nawet zupełny zanik miesiączkowania. W związku z zaburzeniami owulacji symptomem PCOS może być problem z zajściem w ciążę. Inne możliwe objawy to hirsutyzm, czyli nadmierne owłosienie ciała w okolicach twarzy, pachwin, klatki piersiowej czy pleców. Schorzeniu towarzyszą także łysienie, trądzik czy nadmierne przetłuszczanie się skóry i włosów. Ze względu na możliwość występowania insulinooporności jednym z objawów może być przyrost masy ciała, a także trudność w jej redukcji. [1,2]
Na jakiej podstawie stawiana jest diagnoza?
Podstawą rozpoznania PCOS jest spełnienie 2 z 3 tzw. kryteriów rotterdamskich. Należą do nich:
- brak lub rzadko występująca owulacja (ustalane na podstawie badań hormonalnych),
- charakterystyczny obraz policystycznych jajników w badaniu ultrasonograficznym,
- objawy podwyższonego stężenia androgenów we krwi (pomiar stężenia hormonów).
Odnosząc się do najnowszych wytycznych, ustalonych w 2019 roku przez International PCOS Network, policystyczne jajniki są rozpoznawane w przypadku, gdy objętość jajnika wynosi ok. 10 cm3 lub w każdym z jajników obserwuje się min. 20 pęcherzyków o średnicy 2 -9 mm.
Ważną kwestią jest odpowiedni czas wykonywania badań hormonalnych. Hormony powinny zostać oznaczone w pierwszej fazie cyklu, pomiędzy 3. a 5. dniem, licząc od pierwszego dnia miesiączki. Dokonywane są pomiary stężeń:
- testosteronu,
- androstendionu,
- dehydroepiandrosteronu (DHEA-S),
- LH-hormonu luteinizującego,
- FSH–hormonu folikulotropowego,
- SHBG, czyli białka wiążącego hormony płciowe.
Dodatkowym wykorzystywanym testem jest OGTT, czyli test obciążenia glukozą. Polega on na ocenie gospodarki węglowodanowej na podstawie stężenia glukozy we krwi na czczo oraz po 1 i 2 godzinach od spożycia 75 g roztworu glukozy. [1,2]
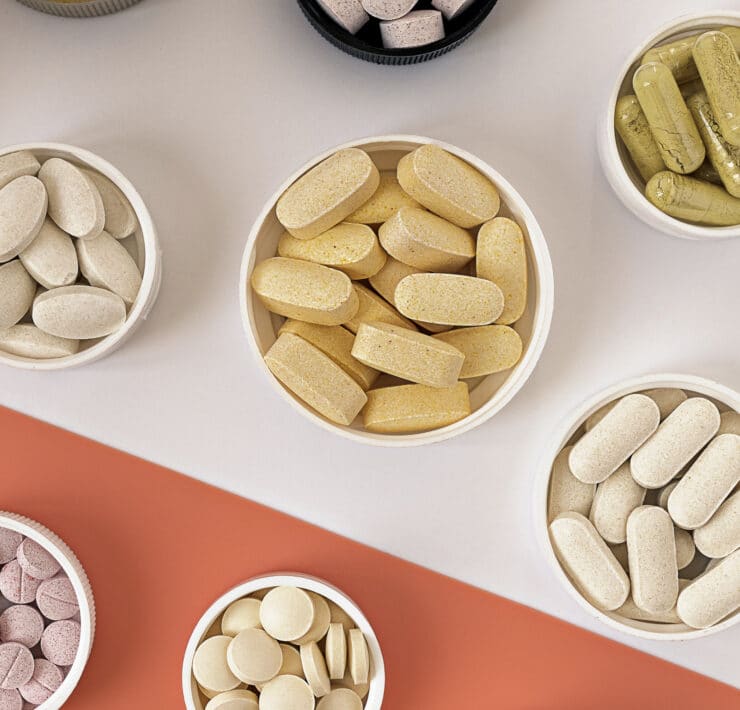
Przegląd wybranych suplementów pomocnych w terapii PCOS
Ilość badań na temat terapii PCOS dynamicznie wzrosła w przeciągu ostatnich lat. Wśród nich pojawia się coraz więcej doniesień na temat suplementów, mogących łagodzić objawy tego schorzenia. Poniższa lista zawiera te z nich, których potencjalne korzystne działanie potwierdzono w badaniach naukowych.
🔎 Przegląd polskich naukowców [32] wskazał, że przy PCOS należy zadbać w pierwszym rzędzie o suplementację na odpowiednim poziomie magnezu, selenu, jodu i wapnia. Dodatkowo warto dbać o odpowiedni poziom żelaza, miedzi, potasu, cynku, manganu i chromu. Z drugiej strony warto minimalizować sód oraz fosfor. Badacze jednak uczulają, żeby nie przekraczać optymalnych dawek z diety i suplementów
N-acetylo-L-cysteina (NAC)
Jedną z substancji badanych w kontekście PCOS jest NAC. Substancja ta jest pochodną aminokwasu cysteiny, która wytwarzana jest w organizmie człowieka. Cysteina może być także dostarczana z produktów spożywczych takich jak mięso, jajka, mleko, orzechy ziemne, soczewica, soja czy nasiona słonecznika.
Dzienne spożycie NAC na poziomie 1,8 g (3 g w przypadku osób otyłych) wpływa na poprawę wrażliwości tkanek na insulinę. Prowadzi to do regulacji gospodarki insulinowej u kobiet ze współtowarzyszącą PCOS insulinoopornością. Ponadto substancja powoduje obniżenie poziomu testosteronu, a co za tym idzie, zmniejszenie hiperandrogenizmu [3].
W badaniu porównującym zastosowanie metforminy (500 mg 3 x/d) i NAC (600 mg 3x/d) w przypadku obu substancji u pacjentek uzyskano:
- zmniejszenie hirsutyzmu i obniżenie stężenia testosteronu,
- obniżenie indeksu HOMA,
- uregulowanie cykli miesięcznych,
- zmniejszenie masy ciała
- regulację gospodarki insulinowej.
Na tej podstawie wywnioskowano, że suplementacja NAC ma porównywalne efekty do terapii metforminą. Dodatkowo NAC wpłynęła na obniżenie poziomu cholesterolu całkowitego i cholesterolu LDL. [4]

Inozytol
Mio-inozytol, będący najczęstszą postacią inozytolu obok D-chiro-inozytolu, to prekursor trifosforanu inzytolu, spełniającego funkcję w regulacji hormonów tj. insulina i FSH. Ze względu na tę funkcję jego użycie może być korzystne między innymi w terapii PCOS. Badania dowodzą, że suplementacja mio-inozytolem obniża poziom insuliny na czczo oraz indeks HOMA-IR, służący ocenie zaawansowania insulinooporności oraz wpływa na redukcję hiperandrogenizmu. [5]
Co więcej, badania dowodzą, że suplementacja inozytolem reguluje cykl miesiączkowy i wpływa na częstsze występowanie cykli owulacyjnych. Substancja ta poprawia parametry gospodarki lipidowej (obniżenie stężenia trójglicerydów (TG), cholesterolu LDL, zwiększenie poziomu cholesterolu HDL). Oprócz tego oddziałuje na obniżenie stężenia hormonu LH, prolaktyny i stosunku LH do FSH. Część badań odnosiła się do jednoczesnej suplementacji kwasem foliowym. Najczęściej stosowaną dawką mio-inozytolu były 4 mg dziennie. Badania wskazują także, że najlepszą opcją suplementacji inozytolu jest łączenie obu form – zarówno mio-inozytolu i D-inozytolu w odpowiedniej proporcji. [6]
W badaniu łączącym suplementację 2 g mio-inozytolu, 0,5 mg tyrozyny, 0,2 mg kwasu foliowego, 55 µg selenu i 40 µg chromu u dużej części badanych kobiet uzyskano uregulowanie cykli miesięcznych i owulacji, obniżenie indeksu HOMA-IR oraz hiperandrogenizmu, a także podwyższenie progesteronu w fazie luteinizującej. [7]
Stanowisko Zespołu Ekspertów Polskiego Towarzystwa Ginekologicznego z 2014 r. zaleca stosowanie preparatu Inofolic (2g inozytolu oraz 200 µg kwasu foliowego) w dawce 2 razy 1 saszetka dziennie. [8]
Chrom
Chrom zaliczany jest do mikroelementów niezbędnych do prawidłowego funkcjonowania organizmu człowieka. Zaobserwowano między innymi, że jego niedobór przyczynia się do rozwoju nietolerancji glukozy, insulinooporności oraz hiperinsulinemii i obniżenia liczby receptorów insulinowych. W badaniach wykazano, że suplementacja chromem (w formie pikolinianiu chromu lub innej III wartościowej postaci) wpłynęła na obniżenie masy ciała, zmniejszenie hirsutyzmu, łagodzenie zmian trądzikowych, a co najważniejsze na poprawę metabolizmu glukozy. [9]
Badania wskazują również, że suplementacja chromem może obniżać indeks HOMA-IR, HOMA-B. W eksperymencie trwającym 8 tygodni, w którym uczestniczki przyjmowały 200 µg pikolinianiu chromu, zaobserwowano obniżenie wskaźników HOMA, wzrost wskaźnika QUICKI, ale także wpływ na poprawę gospodarki lipidowej i insulinowej. [10,11]
Badano także grupę nastolatek (14-17 lat), które przez 6 miesięcy otrzymywały 1000 µg pikolinianiu chromu. W tym eksperymencie zauważono z kolei regulację cykli miesięcznych, obniżenie poziomu testosteronu, redukcję objętości jajników i zmniejszenie liczby obecnych w jajnikach pęcherzyków. [12]
Selen
Selen to pierwiastek śladowy, biorący udział w licznych szlakach biochemicznych, niezbędnych dla prawidłowego funkcjonowania organizmu. Bierze udział m.in. w zmiataniu reaktywnych form tlenu (tzw. wolnych rodników). Źródłami selenu w diecie są m.in. mięso, ryby, nabiał, produkty zbożowe, warzywa kapustne i cebulowe, rośliny strączkowe, orzechy czy szparagi. Warto wspomnieć, że szacuje się, iż spożycie selenu w naszej populacji jest zdecydowanie zbyt niskie w stosunku do zapotrzebowania. [13]
Badanie obejmujące suplementację selenu w dawce 200 μg dziennie przez 8 tygodni wykazało wpływ na obniżenie indeksu HOMA-IR, HOMA-B, regulację gospodarki insulinowej i wzrost indeksu QUICKI, czyli wzrost wrażliwości na insulinę. Co więcej, zaobserwowano obniżenie poziomu trójglicerydów (TG) i cholesterolu VLDL. [14]
W badaniu przeglądowym również potwierdzono wpływ suplementacji selenu na obniżenie wskaźnika HOMA-B i wzrost QUICKI, natomiast nie wykazano efektu w przypadku HOMA-IR. [15]
Cynk
Cynk to pierwiastek śladowy, pełniący niezbędną funkcję w wielu procesach biochemicznych organizmu człowieka, związanych m.in. z ekspresją i stabilizacją genów czy ze wzrostem i podziałem komórek. Co więcej, cynk pełni rolę przeciwutleniacza, odpowiadającego za neutralizację jednej z form wolnych rodników tlenowych. Niezbędny jest także dla rozwoju i prawidłowego funkcjonowania układu immunologicznego. Niedobory cynku charakteryzują się wieloma objawami, a jednym z następstw jest obniżona tolerancja glukozy. [16]
W badaniu eksperymentalnym polegającym na podaży 220 mg siarczanu cynku (zawartość cynku 50 mg) przez 8 tygodni, zaobserwowano obniżenie stężenia glukozy na czczo, poziomów insuliny, redukcję wskaźnika HOMA-IR i HOMA-B oraz wzrost indeksu QUICKI. Zauważono także obniżenie stężenia cholesterolu VLDL. [17]
W innych badaniach potwierdzono oddziaływanie korzystne suplementacji cynku na parametry gospodarki węglowodanowo-insulinowej, odnotowano również wpływ na obniżenie stężenia trójglicerydów, cholesterolu LDL i na wzrost stężenia cholesterolu HDL. Większość badań eksperymentalnych opierała się na podaży 220 mg siarczanu cynku (50 mg cynku). Obecne były także łączące tę suplementację z podażą magnezu (250 mg tlenku magnezu) czy magnezu (100 mg), wapnia (400 mg) i witaminy D (200 IU). [18]
Witamina D3
Rola witaminy D3 w warunkowaniu prawidłowego funkcjonowania organizmu człowieka podkreślana jest od wielu lat. Niedobór tej witaminy wpływa na zaburzenie pracy wszystkich układów organizmu. Sugerowany jest także związek jej niedoboru z objawami PCOS, takimi jak insulinooporność, hirsutyzm czy niepłodność. Witamina D3 dostarczana jest wraz z pożywieniem ( ryby tj. makrela, sardynki, łosoś; mleko, masło, niektóre grzyby (kurki) i suplementami diety. Kolejne źródło tej witaminy to synteza skórna, zachodząca pod wpływem promieniowania UV. [19]
Istnieje ścisła korelacja pomiędzy niedoborem witaminy D3 a zaburzeniami cyklu miesięcznego czy insulinoopornością. Wykazano, że kobiety ze zdiagnozowanym PCOS mają niższe stężenie tej witaminy w surowicy. Badania potwierdziły wpływ stosowania witaminy D3 na wzrost wrażliwości tkanek na insulinę. Naukowcy sugerują szczególnie korzystne oddziaływanie tej witaminy w kontekście stanów przedcukrzycowych, czyli nieprawidłowego stężenia glukozy na czczo czy nieprawidłowej tolerancji glukozy. Wykazano także, że optymalne stężenie witaminy D3 w organizmie, konieczne do zmniejszenia insulinooporności, jest na poziomie 32-47,6 ng/mL. Natomiast podstawowe pożądane stężenie to >30 ng/mL. Należy przy tym pamiętać, że zbyt wysokie stężenie witaminy D (ok. 150 ng/mL) jest toksyczne, dlatego suplementację należy prowadzić rozważnie. [19]
Wykazano, że niedobór witaminy D3 w surowicy u kobiet ze zdiagnozowanym PCOS skorelowany jest także z zaburzeniami gospodarki lipidowej (nieprawidłowe stężenia cholesterolu całkowitego i cholesterolu LDL) czy podwyższonym wskaźnikiem HOMA-IR. [20] Jednak badanie oceniające oddziaływanie hipersuplementacji witaminy D3 na zaburzenia związane z PCOS, potwierdziły wyłącznie wpływ na obniżenie poziomu glukozy na czczo i stężenia cholesterolu całkowitego przy podaży zarówno <4000 IU, jak i >4000 IU tej witaminy. [21]
🔎 Zgodnie z meta-analizą Cochrane z 2023 roku [31] suplementacja witaminy D w dawkach powyżej 3000 IU nie przynosi zauważalnych korzyści dla pacjentek.
Można zatem wnioskować, że najkorzystniejsze jest utrzymywanie prawidłowego stężenia witaminy D3 w surowicy (>30-50 ng/mL) i dopasowanie dawki suplementacji do jej aktualnego poziomu.
Zespół Ekspertów do spraw Suplementów Diety, działający przy Głównym Inspektoracie Sanitarnym, ustalił w 2021 r. maksymalną ilość witaminy D3 w zalecanej dziennej porcji w suplementach diety na poziomie 2000 IU (50 µg) dla populacji zdrowych dorosłych do 75 roku życia. Dla konsumentów powyżej 75. roku życia zalecana jest dawka 4000 IU (100 µg) witaminy D3. Podkreślono konieczność sprawdzenia aktualnego poziomu witaminy D3 w surowicy przed podjęciem decyzji o dawce suplementacji. [22]

Pozostałe suplementy niosące potencjalne korzyści
Kwasy omega-3 i witamina E
Działanie kwasów omega-3 na obniżenie poziomu glukozy na czczo czy inne profile hormonalne nie zostało potwierdzone. Kwestia wpływu na redukcję insulinooporności również pozostaje dyskusyjna, choć pojawiają się badania potwierdzające takie działanie.[6] Badania dowodzą natomiast, że 12-tygodniowa suplementacja 1000 mg kwasów omega-3 z oleju lnianego zawierającego 400 mg kwasu α-linolenowego plus 400 IU witaminy E spowodowała obniżenie stężenia testosteronu i redukcję insulinooporności. [23]
🔎 Meta-analiza z 2022 roku [28] przeanalizowała efekty suplementacji witaminy E na pacjentów z PCOS. Wykazała ona korzyści dla profilu lipidowego, działanie przeciwzapalne i antyoksydacyjne. Efekt ten wystąpił dla stosowania samej witaminy E, jak i w połączeniu z kwasami omega-3 i magnezem.
Bioflawonoidy
Bioflawonoidy to substancje pochodzenia roślinnego, mające udowodnione właściwości antyoksydacyjne, przeciwzapalne czy antyproliferacyjne. W jednym z badań potwierdzono wpływ przyjmowania 36 mg genisteiny (flawonoid występujący w soi) dziennie przez 3 miesiące na poprawę parametrów lipidowych u kobiet z PCOS.[6]
W badaniu przeglądowym analizującym badania przeprowadzone wśród ludzi i na modelach zwierzęcych wywnioskowano również pozytywny wpływ kwercetyny (występująca m.in.w zielonej herbacie) na obraz i funkcje jajników. Zaobserwowano także ich wpływ na redukcję poziomu testosteronu, hormonu luteinizującego (LH) i redukcję insulinooporności. Konieczne są jednak dalsze badania na ten temat. [24]
Karnityna
Karnityna to związek syntetyzowany w organizmie m.in. w wątrobie, biorący udział w procesach metabolicznych, związanych z transportem kwasów tłuszczowych czy metabolizmem glukozy. Badania potwierdzają, że kobiety ze zdiagnozowanym PCOS cechują się niższym poziomem tego związku w porównaniu z kobietami zdrowymi. Uznano, że obniżone stężenie karnityny może mieć związek z występowaniem insulinooporności i hiperandrogenizmu. [6] W badaniu polegającym na podaży karnityny (3 g dziennie) kobietom leczonym za pomocą klomifenu odnotowano poprawę owulacji, większy wskaźnik ciąż, podwyższony poziom estradiolu oraz poprawę parametrów lipidowych w porównaniu do pacjentek otrzymujących wyłącznie klomifen. [25]
Preparaty ziołowe
Istnieją także doniesienia o korzyściach płynących ze stosowania preparatów ziołowych, mogących wpływać pozytywnie na regulację owulacji, cykli miesiączkowych, insulinooporność, hiperinsulinemię, gospodarkę lipidową czy hiperandrogenizm. Poniżej wymieniono niektóre z nich.
Badania sugerują wpływ cynamonu na obniżenie stężenia cholesterolu całkowitego, cholesterolu LDL oraz podwyższenie poziomu cholesterolu HDL. Co więcej, zauważono wpływ na obniżenie wskaźnika HOMA-IR, a także poprawę owulacji i regularności cykli miesięcznych.
🔎 Jedno z badań klinicznych [29] wykazało, że cynamon miał podobny efekt dla redukcji insulinooporności oraz poziomu testosteronu, jak wspomniana wcześniej metformina. We wspomnianym badaniu udało się także dowieść korzyści dla gospodarki hormonalnej ze spożycia imbiru.
🔎 Wśród kobiet ze współwystępującą otyłością na diecie niskokalorycznej udało się także udowodnić w badaniach [30] korzyści ze stosowania zielonego kardamonu dla gospodarki hormonalnej i ekspresji genów.
Z kolei herbata chińska (Camellia sinensis) może oddziaływać na spadek poziomu testosteronu, obniżenie poziomu insuliny na czczo, redukcję masy ciała. Natomiast ekstrakt z owoców niepokalanka (Vitex agnus-castus L.) może regulować cykl miesięczny, obniżać poziom testosteronu, prolaktyny i DHEAS. Odnotowano także potencjalne korzystne oddziaływanie ekstraktu z nasion kozieradki pospolitej (Trigonella foenum-graecum L.) na redukcję objętości jajników i ilości pęcherzyków oraz regulację cykli miesięcznych, a także obniżenie wskaźnika HOMA-IR. [26]
🔎 Badanie przeprowadzone przez Victórię Dogani Rodrigues i współpracowników [33] wykazało, że astaksantyna, silny przeciwutleniacz otrzymywany z alg, może poprawiać wskaźniki całkowitej pojemności antyoksydacyjnej w płynie pęcherzykowym u kobiet z zespołem policystycznych jajników. Nie wykazano jednak spójnego wpływu na inne biomarkery stresu oksydacyjnego ani na wyniki reprodukcyjne, takie jak wskaźniki zapłodnienia i wyniki ciążowe.
Kluczowy element w terapii PCOS – dieta w PCOS w pigułce
Terapia PCOS to działanie szerokospektralne obejmujące zmianę stylu życia czy redukcję masy ciała w przypadku jej nadmiaru. Jednym z jej kluczowych elementów jest także odpowiednio dostosowana dieta (w rozumieniu żywienia) oparta na produktach o niskim indeksie i ładunku glikemicznym, uwzględnieniu odpowiedniej podaży błonnika, białka (z uwzględnieniem jego źródeł roślinnych), a także nienasyconych kwasów tłuszczowych.
Niezwykle istotne jest również dostarczanie odpowiednich ilości witamin (szczególnie z grupy B) oraz składników mineralnych (potas, magnez, cynk, selen), co zapewnić może spożywanie różnorodnych produktów i odpowiedniej ilości warzyw i owoców (co najmniej 400 g dziennie wg zaleceń WHO). [27]
Podsumowanie
PCOS to schorzenie, dotykające coraz większego odsetka kobiet. Leczenie, obejmujące farmakoterapię, zmianę stylu życia i modyfikacje dietetyczne, może być dodatkowo uzupełnione i wspierane przez odpowiednio dobraną suplementację, należy jednak pamiętać, że nie zastąpi ona farmakoterapii ani koniecznych zmian stylu życia. Suplementację należy również skonsultować z lekarzem. Ważne także, aby zachować zdrowy rozsądek i nie porywać się na stosowanie każdego proponowanego w mediach suplementu, ani nie suplementować wszystkich możliwych preparatów naraz. Warto szukać rzetelnych danych na portalach naukowych polskich i zagranicznych, weryfikując informacje przekazywane w mediach, czasopismach czy przez celebrytów.
W świetle powyższych danych naukowych zasadne wydaje się stosowanie suplementacji głównie inozytolu, NAC, witaminy D, chromu, cynku i selenu. Przy wyborze preparatu należy dokładnie przeczytać jego skład, aby mieć pewność, jaką ilość danej substancji aktywnej dostarcza. W miarę możliwości należy także decydować się na zakup preparatu w formie leku, a nie suplementu. Trzeba pamiętać, że preparat leczniczy (lek) w porównaniu do suplementu diety zawiera dawkę składników aktywnych o działaniu terapeutycznym, farmakologicznym. Z kolei w suplementach diety jest to zwykle dawka żywieniowa, gdyż taki charakter prawny posiada suplement diety.
Bibliografia:
- Stefanowicz, E. (2021). Zespół policystycznych jajników (PCOS). https://www.mp.pl/pacjent/ginekologia/choroby/260942,zespol-policystycznych-jajnikow-pcos
- Mohammad, M.B. Seghinsara, A.M. (2017) Polycystic Ovary Syndrome (PCOS), Diagnostic Criteria, and AMH. Asian Pac J Cancer Prev. 2017; 18(1), 17–21.
- Fughesu, A.M.Ciampelli, M. Muzj, G.et all. (2002) N-acetyl-cysteine treatment improves insulin sensitivity in women with polycystic ovary syndrome. Fertil Steril.77(6), 1128-35.
- Oner, I. I. (2011) Muderris Clinical, endocrine and metabolic effects of metformin vs N-acetyl-cysteine in women with polycystic ovary syndrome. Eur J Obstet Gynecol Reprod Biol. 159(1):127-31
- Unfer, V. Facchinetti, F. Orrùet, B. et all. ( 2017) Myo-inositol effects in women with PCOS: a meta-analysis of randomized controlled trials, Endocr Connect.6(8), 647-658.
- Günalan, E. Yaba, A. Yılmaz B. (2028) The effect of nutrient supplementation in the management of polycystic ovary syndrome-associated metabolic dysfunctions: A critical review. J Turk Ger Gynecol Assoc.19(4), 220–232.
- Oliva, M.M. Zuev, V. Lippa A.et all. (2019) Efficacy of the synergic action of myoinositol, tyrosine, selenium and chromium in women with PCOS. Eur Rev Med Pharmacol Sci.23(19), 8687-8694.
- Oszukowski, P. Jakimiuk, A. Spaczyński, M.et all. (2014) Stanowisko Zespołu Ekspertów Polskiego Towarzystwa Ginekologicznego dotyczące stosowania preparatów zawierających myo-inozytol przez pacjentki z zespołem policystycznych jajników (PCOS). Ginekol Pol. 85, 158-160.
- Piotrowska, A. Pilch, W. Tota, Ł. Nowak, G. (2018) Biologiczne znaczenie chromu III dla organizmu człowieka. Medycyna Pracy 69 (2), 211-223.
- Heshmati, J. Omani- Samani, R. Vesali,S. et all. (2018) The Effects of Supplementation with Chromium on Insulin Resistance Indices in Women with Polycystic Ovarian Syndrome: A Systematic Review and Meta-Analysis of Randomized Clinical Trials. Horm Metab Res. 50(3), 193-200.
- Jamilian, M. Asemi, Z. (2015) Chromium Supplementation and the Effects on Metabolic Status in Women with Polycystic Ovary Syndrome: A Randomized, Double-Blind, Placebo-Controlled Trial. Ann Nutr Metab. 67(1), 42-8.
- Amr, N. Abdel-Rahim, H.E. (2015) The effect of chromium supplementation on polycystic ovary syndrome in adolescents. J Pediatr Adolesc Gynecol. 28(2), 114-8.
- Ratajczak, M. Gietka- Czernel, M. (2016) Rola selenu w organizmie człowieka. Borgis- Postępy Nauk Medycznych 12, 929- 933.
- Jamilian, M. Maryamalsadat, R. Zohren Fakhrie, K. et all. (2015) Metabolic response to selenium supplementation in women with polycystic ovary syndrome: a randomized, double-blind, placebo-controlled trial. Clin Endocrinol (Oxf). 82(6), 885-91.
- Gorabi, A.M. Hasani, M. Djalalinia, S.et all. (2019) Effect of selenium supplementation on glycemic indices: a meta-analysis of randomized controlled trials, J Diabetes Metab Disord. 18(2), 349-362
- Mońka, I. Wiechuła, D. (2017) Znaczenie cynku dla organizmu ludzkiego w aspekcie suplementacji tego pierwiastka. Annales Academiae Madicae Silesiensis 71, 314- 325.
- Foroozanfard, F. Jamilian, M. Jafari, Z.et all. (2015) Effects of zinc supplementation on markers of insulin resistance and lipid profiles in women with polycystic ovary syndrome: a randomized, double-blind, placebo-controlled trial. Exp Clin Endocrinol Diabetes.123(4), 215-20
- Nasiadek, M. Stragierowicz, J. Klimczak, M. Kilanowicz, A. (2020) The Role of Zinc in Selected Female Reproductive System Disorders. Nutrients. 12(8), 2464.
- Brzozowska, M. Karowicz-Bilińska, A. (2013) Rola niedoboru witaminy D w patofizjologii zaburzeń występujących w zespole policystycznych jajników. Ginekol Pol. 84 456-460
- Wang, L. Wen, X. Li, F. et all. (2020) Vitamin D deficiency is associated with metabolic risk factors in women with polycystic ovary syndrome: a cross- sectional study in Shaanxi- China. Front Endocrinol (Lausanne) 11, 171
- Wang, L. Wen, X. Lv, S. et all. (2020) Effects of vitamin D supplementation on metabolic parameters of women with polycystic ovary syndrome: a meta-analysis of randomized controlled trials. Gynecol Endocrinol 10, 1-10
- Główny Inspektorat Sanitarny (2021) Uchwała w sprawie wyrażenia opinii dotyczącej maksymalnej dawki witaminy D w zalecanej dziennej porcji w suplementach diety. Dostępna pod adresem internetowym: https://www.gov.pl/web/gis/zespol-do-spraw-suplementow-diety
- Ebrahimi, F.A. Samimi, M. Foroozanfard, F. et all. (2017) The effects of omega-3 fatty acids and vitaminE Co-Supplementation on indices of insulin resistance and hormonal parameters in patients with polycystic ovary syndrome: a randomized, double-blind, placebo-controlled trial. Exp Clin Endocrinol Diabetes 125(6), 353-359
- Pourteymour Fard Tabrizi, F. Hajizadeh-Sharafabad, F. Vaezi, M. (2020) Quercetin and polycystic ovary syndrome, current evidence and future directions: a systemaic review. J Ovarian Rez 13(1), 11
- Ismail, A.M. Hamed, A.H. Saso, S. et. all (2014) Adding L-carnitine to clomiphene resistant PCOS women improves the quality of ovulaion and the pregnancy rate. A randomized clinial trial. Eur J Obstet Gynecol Reprod Biol. 180, 148-152
- Jazani Moini, A. Nasimi Doost Azgomi, H. Nasimi Doost Azgomi, A. et all (2019) A comprehensive review of clinial studies with herbal medicine on polycystic ovary syndrome (PCOS). Daru. 27(2), 863-877
- Kostecka, M. (2018) Zespół policystycznych jajników- rola diety i suplementacji we wspomaganiu leczenia. Kosmos. Problemy nauk biologicznych.67, 855-862
- Heidari, H., Hajhashemy, Z., & Saneei, P. (2022). A meta-analysis of effects of vitamin E supplementation alone and in combination with omega-3 or magnesium on polycystic ovary syndrome. Scientific reports, 12(1), 19927. https://doi.org/10.1038/s41598-022-24467-0
- Dastgheib, M., Barati-Boldaji, R., Bahrampour, N., Taheri, R., Borghei, M., Amooee, S., Mohammadi-Sartang, M., Wong, A., Babajafari, S., & Mazloomi, S. M. (2022). A comparison of the effects of cinnamon, ginger, and metformin consumption on metabolic health, anthropometric indices, and sexual hormone levels in women with poly cystic ovary syndrome: A randomized double-blinded placebo-controlled clinical trial. Frontiers in nutrition, 9, 1071515. https://doi.org/10.3389/fnut.2022.1071515
- Cheshmeh, S., Elahi, N., Ghayyem, M., Mosaieby, E., Moradi, S., Pasdar, Y., Tahmasebi, S., & Moradinazar, M. (2022). Effect of green cardamom on the expression of genes implicated in obesity and diabetes among obese women with polycystic ovary syndrome: a double blind randomized controlled trial. Genes & nutrition, 17(1), 17. https://doi.org/10.1186/s12263-022-00719-6
- Cochrane KM, Bone JN, Williams BA, Karakochuk CD. Optimizing vitamin D status in polycystic ovary syndrome: a systematic review and dose-response meta-analysis. Nutr Rev. 2023 Sep 28:nuad117. doi: 10.1093/nutrit/nuad117. Epub ahead of print. PMID: 37769789.
- Pokorska-Niewiada K, Zietek M, Swiatkowska-Freund M, Szczuko M. How important are elements in polycystic ovary syndrome? Should they be supplemented? A systematic review. Ginekol Pol. 2023 Sep 15. doi: 10.5603/gpl.96864. Epub ahead of print. PMID: 37713235.
- Rodrigues VD, Boaro BL, Laurindo LF, Chagas EFB, de Lima EP, Laurindo LF, Barbalho SM. Exploring the benefits of astaxanthin as a functional food ingredient: Its effects on oxidative stress and reproductive outcomes in women with PCOS – A systematic review and single-arm meta-analysis of randomized clinical trials. Naunyn Schmiedebergs Arch Pharmacol. 2024 Sep 13. doi: 10.1007/s00210-024-03432-w. Epub ahead of print. PMID: 39269488.
- Data pierwotnej publikacji: 30.04.2021
- Data ostatniej aktualizacji o wyniki badań: 19.09.2024
Dietetycy.org.pl » Dietetyka » Dietetyka kliniczna » Suplementy w PCOS. O te składniki warto zadbać
Dyplomowany dietetyk. Absolwentka studiów I st. i studentka II st. kierunku Dietetyka na Wydziale Lekarskim Collegium Medicum UJ. Oprócz tego studentka Wydziału Wokalno-Aktorskiego Akademii Muzycznej w Krakowie. W życiu zawodowym planuje połączyć zamiłowanie do nauk biomedycznych i zawód dietetyka klinicznego z pasją do śpiewu klasycznego.
 Strefa dla zalogowanych >
Strefa dla zalogowanych >